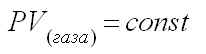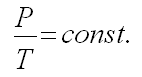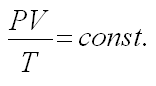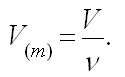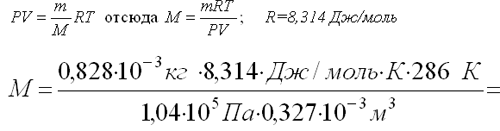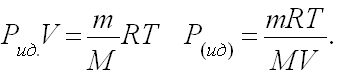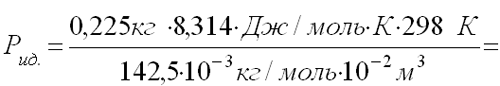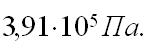РЕШЕНИЕ ЗАДАЧ С ИСПОЛЬЗОВАНИЕМ ГАЗОВЫХ
ЗАКОНОВ
Урок химии в 11 классе
Цели урока: получить практические навыки
применения газовых законов для решения
химических задач,
установить межпредметные связи с физикой и
экологией.
Тип урока: урок закрепления и обобщения
изученного материала
Форма урока: практическое занятие
Основные методы: объяснительно-иллюстративный,
метод проблемного изложения учебного материала,
самостоятельная работа учащихся.
Средства обучения: справочный материал;
тексты задач.
Ход урока.
I. Блок мотивации и актуализации.
Постановка цели:
- Сегодня на занятии мы должны научиться решать конкурсные задачи с использованием газовых законов. Для этого придется вспомнить курс физики.
II. Блок изучения материала.
(весь изложенный ниже теоретический материал
имеется у учащихся в виде карточек)
- Итак, какие газовые законы известны вам из курса физики?
(ученики называют законы, учитель записывает их на доске)
а) Закон Бойля-Мариотта
При постоянной температуре произведение давления газа на его объем есть величина постоянная, или объем газа обратно пропорционален давлению, при котором он находится.
б) Закон Гей-Люссака
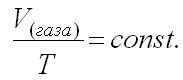
При постоянном давлении изменение объема газа прямо пропорционально температуре.
в) Закон Шарля
При постоянном объеме давление прямо пропорционально температуре.
г) Объединенный газовый закон
д) Уравнение Клапейрона – Менделеева 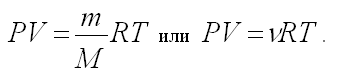
Давайте более подробно рассмотрим уравнение
Клапейрона – Менделеева и вспомним, что означают
входящие в него величины ![]()
![]()
Вопрос учащимся: Что означает величина R?
![]() (универсальная газовая постоянная).
(универсальная газовая постоянная).
Вопрос учащимся: Что означает величина ![]() ?
?
- Это количество вещества.
Вопрос учащимся: В каких единицах измеряется количество вещества?
- Для измерения количества вещества используют
особую величину “моль” . 1 моль содержит столько
структурных частиц, сколько атомов углерода
содержится в 12 г изотопа C12.
В 1 моль содержится примерно ![]() структурных частиц.
структурных частиц.
Вопрос учащимся: Как можно найти количество вещества?
- Для того, чтобы найти количество вещества, надо массу разделить на молярную массу:
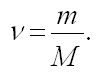
Часто используют понятие молярного объема V(m), который равен объему одного моль вещества.
С использованием понятия молярного объема уравнение Клапейрона – Менделеева
может быть записано в виде: 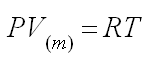
- Теперь вспомним один из важнейших законов химии - Закон Авогадро.
е) Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Для химических расчетов применяют следствия из Закона Авогадро:
Следствие 1 Моль любого газа при нормальных условиях занимает один и тот же объем, равный приблизительно 22,4 л.
Вопрос учащимся: Какие параметры характеризуют состояние газа при нормальных условиях? ( ученики перечисляют, учитель записывает).
Нормальными условиями считаются: давление ![]()
Таким образом, в соответствии с законом
Авогадро: ![]()
Вопрос учащимся: При решении задач часто приходится проводить расчеты для условий, отличающихся от нормальных. Как привести параметры газа к нормальным условиям?
Для приведения объема газа к нормальным условиям можно пользоваться объединенным газовым законом:
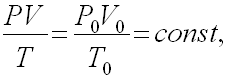 где V - объем газа при
давлении P и температуре T
где V - объем газа при
давлении P и температуре T
![]() – параметры,
характеризующие параметры газа при нормальных
условиях.
– параметры,
характеризующие параметры газа при нормальных
условиях.
Масса одного и того же объема газа
тем больше, чем больше масса его молекул. Если в
равных объемах газов при одинаковых условиях
содержится одинаковое число молекул, то
очевидно, что отношение масс равных объемов
газов будет равно отношению их молекулярных масс
или отношению численно равных им молярных масс,
то есть m1/m2 = M1/M2,
где
m1 - масса объема первого газа,
m2 - масса такого же объема второго
газа,
M1 - молярная масса первого газа,
M2 - молярная масса второго газа.
Отношение массы определенного объема одного газа к массе такого же объема другого газа, взятого при тех же условиях, называется относительной плотностью первого газа по второму (обозначается буквой - D).
Тогда m1/m2 = D и D = M1/M2, откуда M1 = M2 • D.
Обычно плотность газов определяют по отношению к водороду M(H2) = 2 г/моль или к воздуху М(возд.) = 29 г/моль. В итоге получим: М = 2D (H2) и M = 29 D( возд.).
Таким образом, зная плотность газа по водороду или по воздуху, можно легко определить его молярную, а, следовательно, и относительную молекулярную массу и сформулировать II следствие из закона Авогадро.
Следствие 2 Относительная плотность газов – величина, показывающая, во сколько раз один газ тяжелее (легче) другого, т.е. равна отношению плотностей газов или молярных масс.
Молярная масса вещества (M), а значит, и относительная молекулярная масса (Mr) вещества в газообразном состоянии, численно равна удвоенной плотности паров этого вещества по водороду.
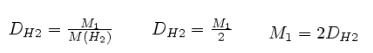
Измерения объемов газов обычно производят при
условиях, отличных от нормальных.
Если мы рассматриваем смесь газов, необходимо
использовать закон Дальтона
ж) Закон Дальтона (для газовой смеси)
Общее давление газовой смеси равно сумме парциальных давлений газов, входящих в эту смесь:
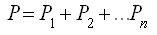
Пояснение. В некоторых текстах задач встречаются внесистемные единицы измерений различных величин; необходимо уметь их переводить в систему СИ.
Внесистемные единицы давления: 1 атм.=101325 Па; 1 мм рт. ст. = 133,3 Па.
Перевод температуры: ![]()
T - температура по шкале Кельвина, t 0 C - температура по шкале Цельсия.
- Итак, мы повторили основные теоретические положения и сейчас перейдем к практике и научимся решать задачи этого типа. У Вас на столах находятся тексты задач – разбираем 1-ю задачу.
I этап
(учитель сам решает с объяснением задачу у
доски)
Задача 1.
Какой объем (н.у.) займут 0,4•10-3 м3 газа,
находящегося при 50оС и давлении 0,954•105Па?
Учитель записывает на доске, ученики в тетради условие:
| Дано V = 0,4•10-3 м3 t = 50oC; T=323 К P=0,954•105Па V0 - ? |
Решение Для приведения объема газа к н.у. используем 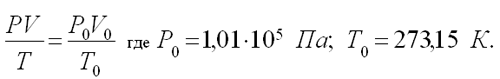 |
Отсюда 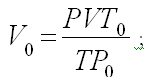
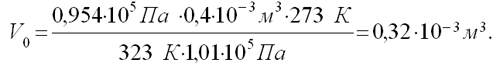
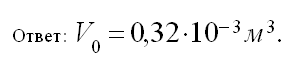
II этап
(текст задачи читают сами учащиеся, записывают условие задачи в тетрадь; учитель комментирует решение, записывая его на доске)
Задача 2.
Масса 0,327•10-3 м3 газа, при 13оС и давлении 1,04•105Па равна 0,828•10-3 кг. Вычислить молярную массу газа.
(Учитель предлагает составить план решения данной задачи; опрашивает 2-3 учеников, затем решает задачу на доске с их помощью).
| Дано: V = 0,4•10-3 м3 t = 50oC; T=323 К P=0,954•105Па |
Решение: Для решения задачи применим уравнение Клапейрона – Менделеева
|
V - ? |
III этап
Задача 3, аналогичная предыдущей; дается время (3-5 минут), чтобы все решали на местах. Для выполнения задания учитель вызывает сильного ученика, чтобы он объяснил у доски решение данной задачи.
Задача 3.
Определить молярную массу ацетона, если он в
парообразном состоянии при температуре 87оС
и давлении 720 мм рт. ст. занимает объем 0,5 л навеска
взятого вещества 0,93 г.
Ответ: ![]()
Решение этой задачи аналогично решению предыдущей. Особенностью является необходимость перевода давления из мм рт. ст. в Паскали.
IV этап
Предлагаются тексты задач по мере их усложнения. Каждый решает индивидуально. Учитель наблюдает, как учащиеся справляются с заданиями. Первый решивший выписывает на доске свое решение и комментирует его.
Задача 4.
225 г паров хлорбензола, находясь при температуре 25оС в резервуаре на 10 л, создают давление в 0,51 МПа. Оцените отклонение состояния этих паров от идеального газа. Чем можно объяснить такое отклонение?
| Дано: V = 10 л =10-2 м3 t = 25o C; T=298 К М=142,5•10-3 кг/моль P=5,1•105 Па |
Решение: По данным задачи определяем, какое могло бы быть давление идеального газа при тех же условиях, и сравниваем с давлением реального газа
R=8,314 Дж/моль Подставляем значения величин данные в условии задачи.
|
Р - ? |
![]() Изменение давления можно объяснить
взаимодействием молекул.
Изменение давления можно объяснить
взаимодействием молекул.
III. Блок подведения итогов и рефлексии
Сегодня на уроке мы вспомнили основные газовые законы, их математические выражения, единицы измерения, потренировались на конкретных примерах в решении задач на газовые законы, в основном на уравнение Клапейрона – Менделеева. На следующем занятии мы разберем задачи на смеси газов.
IV. Домашнее задание:
Повторить основные газовые законы, решить задачу
однотипную с разобранной на уроке.
- Задачи для самостоятельной работы типовые и нестандартные можно найти в приложении 1. Там же представлены решения пяти различных по сложности задач
При подготовке к уроку была использована литература:
- Архангельская О.В. Использование универсальной газовой постоянной при решении
- Кузьменко Н.Е., Еремин В.В., Попков В.А. Начала химии. Современный курс для
задач //Химия в школе - 1994, №2, с. 51-53.
поступающих в ВУЗы. – М.: Экзамен, 2001.