Цели урока:
- учебные: рассмотреть строение, физические свойства, химические свойства, получение и применение оксида углерода (II) и оксида углерода (IV).
- воспитательные: обсудить проблемы экологии и здоровья человека в зависимости от содержания оксидов углерода в окружающей среде в связи с хозяйственной деятельностью человека.
Методы опроса:
- сообщения учащихся;
- ответы учащихся “у доски” (по карточкам).
Методы изучения нового материала:
- рассказ учителя;
- сообщения учащихся;
- демонстрационный эксперимент.
Оборудование и реактивы:
- прибор для получения газов, химический стакан (для собирания углекислого газа), спиртовка, спички, лучинка;
- раствор соляной кислоты (HCl), раствор известковой воды (Ca(OH)2), кусочки мрамора (CaCO3), индикатор (лакмус).
Демонстрационный опыт:
Получение и собирание углекислого газа; качественная реакция на углекислый газ (пропускание его через раствор известковой воды), распознавание углекислого газа (внесение тлеющей лучинки).
ПОСТРОЕНИЕ ЗАНЯТИЯ
I. Актуализация опорных знаний (повторение, закрепление изученного)
Урок начинается с повторения вопросов по теме предыдущего урока “Углерод. Аллотропные модификации углерода”.
Отвечают 4 учащихся на вопросы № 1, 2 – подготовка у доски; в это время, пока двое готовятся, заслушиваются подготовленные (небольшие) сообщения об аллотропных модификациях углерода.
Вопросы для повторения:
1. Напишите уравнения химических реакций, подтверждающие химические свойства углерода – простого вещества:
а) взаимодействия с серой;
б) взаимодействие с алюминием;
в) взаимодействие с оксидом свинца (IV) – это уравнение химической реакции рассмотреть с точки зрения окислительно-восстановительных свойств.
Чем в этих химических реакциях является углерод – окислителем или восстановителем? Почему? Где используется свойство углерода как восстановителя?
2. Напишите электронную формулу атома элемента углерода, покажите распределение валентных электронов по атомным орбиталям. Укажите возможные степени окисления атома углерода в соединениях, напишите формулы этих соединений.
3. Расскажите о строении и свойствах аллотропных модификациях углерода: а) алмаза; б) графита.
Время на повторение – 10-15 минут.
Ответы:
1а) ![]() , С –
восстановитель;
, С –
восстановитель;
1б) ![]() , С –
окислитель;
, С –
окислитель;
1в) ![]() , С –
восстановитель, Pb – окислитель.
, С –
восстановитель, Pb – окислитель.
1| ![]() , процесс
восстановления
, процесс
восстановления
1| ![]() , процесс
окисления
, процесс
окисления
Свойство углерода как восстановителя используется в металлургии для восстановления металлов из их оксидов.
2. 6С* 1s2 | 2s22p2
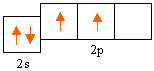
степень окисления (+2) - ![]() - оксид углерода (II)
- оксид углерода (II)
6
C* 1s2 | 2s12p3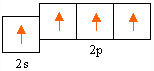
в возбужденном состоянии степень окисления (+4) – СО2 – оксид углерода (IV)
![]() -
восстановитель. Почему?
-
восстановитель. Почему?
![]() - не может
быть восстановителем. Почему?
- не может
быть восстановителем. Почему?
Об этом узнаете чуть позже!!!
3. Рассказ о строении и свойствах аллотропных модификациях углерода в Приложении 1.
II. Вводимые опорные химические понятия и представления (новый материал)
Учитель.
Таким образом, типичные соединения, в которых углерод представляет характерные для него как неметалла степени окисления – это оксиды углерода:
- степень окисления (+2) – оксид углерода (II),
угарный газ, ![]()
- степень окисления (+4) – оксид углерода (IV),
углекислый газ, ![]()
Цель сегодняшнего урока – знакомство с этими оксидами углерода.
Что вы слышали, можете сказать об этих веществах? Что знаете? Где встречаются в природе и как образуются эти соединения? Где и как используются? Каково их физиологическое воздействие на организм человека?
Заслушать (!) ответы учащихся, обсудить их правильность, дополнить сведениями о строении молекул оксидов углерода и их химических свойствах.
1) Угарный газ – оксид углерода (II)
Оксид углерода (II) СО позволяет повторить ковалентную полярную связь и закрепить два механизма ее образования: обменный и донорно-акцепторный. Кроме этого, рассмотрение строения молекулы этого вещества позволит начать формирование представление о различиях понятий “степень окисления” и “валентность”.
Рассмотрим строение с определения степени
окисления элементов: ![]() . Атом углерода передал в общее
пользование два электрона, а более
электроотрицательный атом кислорода оттянул к
себе два электрона:
. Атом углерода передал в общее
пользование два электрона, а более
электроотрицательный атом кислорода оттянул к
себе два электрона:
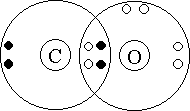
Но отсюда видно, что при таком “раскладе сил” у углерода не будет заветной восьмерки электронов на внешнем уровне – четыре своих и два общих с атомом кислорода. Как быть? Очевидно, атому кислорода придется передать в общее пользование одну свою свободную электронную пару, т.е. выступить в роли донора. Акцептором будет атом углерода:
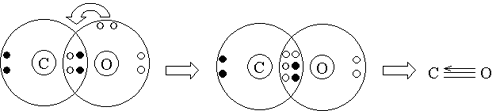
Т.е. ковалентных связей будет три, а оттянутых от кислорода к углероду электронов – два.
Исходя из строения молекулы, учащиеся прогнозируют свойства СО: т.к. у атома углерода осталось еще два электрона на внешнем уровне, то СО может проявлять восстановительные свойства, взаимодействуя с окислителем – кислородом, галогеном, оксидами металлов (восстанавливая их, металлы, из оксидов):
1) 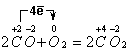 , СО –
восстановитель, О2 - окислитель
, СО –
восстановитель, О2 - окислитель
2| ![]() , процесс
окисления
, процесс
окисления
1| ![]() , процесс
восстановления
, процесс
восстановления
2) ![]() (фосген), СО
– восстановитель, Cl2 – окислитель
(фосген), СО
– восстановитель, Cl2 – окислитель
3) 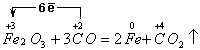 , Fe2O3
– окислитель, СО – восстановитель
, Fe2O3
– окислитель, СО – восстановитель
Но ведь атом углерода может, очевидно, и забирать у восстановителя потерянные им электроны или даже использовать их сильные восстановительные свойства, и не только взять у них отданные электроны, но и даже большее число их. Кто же может уступить свои электроны, т.е. быть восстановителем? Из известных уже Вам (учащимся) веществ – это водород. Например:
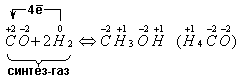
Характерны ли для угарного газа свойства кислотных оксидов, ведь это оксид неметалла? Нет!!! Ему не соответствует кислота, он не взаимодействует с образованием солей – это несолеобразующий оксид. Получить можно:
1. горением углесодержащих веществ в недостатке кислорода:
а) ![]()
б) ![]()
2. в лаборатории:
![]()
муравьиная
кислота
Далее короткое сообщение учащегося об угарном газе (Приложение 2).
2. Углекислый газ – оксид углерода (IV)
В высшем оксиде углерода (IV) – СО2 – у углерода высшая степень окисления (+4), равная номеру группы, в которой стоит элемент углерод в периодической системе.
Строение молекулы СО2 ученики разбирают легко сами:
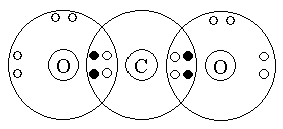
или
![]()
Проблемный вопрос классу: “Почему молекула воды H2O – диполь, а молекула СО2 – неполярна?
Полярность молекулы зависит от двух факторов:
1. от полярности связи, которая определяется значениями электроотрицательности элементов, образующих химическую связь;
2. от геометрии молекулы.
Так молекула H2O имеет угловое строение и молекула воды полярна, а молекула СО2 имеет линейное строение, и несмотря на ковалентную полярную химическую связь, молекула углекислого газа неполярна.
Строение молекулы СО2: линейная, симметричная в пространстве; благодаря симметричному расположению связей молекула неполярна; межмолекулярные связи слабые, поэтому СО2 газ, хотя легко сжижается при комнатной температуре и давлении 6Мпа; при температуре (-80°С) – затвердевает (“сухой лед”).
Физические свойства:
СО2 – бесцветный газ, в 1,5 раза тяжелее воздуха, не поддерживает горение и дыхание; хорошо растворяется в воде (в 1 объеме воды растворяется 2,5 объема углекислого газа при 18°С).
3. Получение, собирание, распознавание углекислого газа.
В лаборатории СО2 получают действием соляной (HCl) или азотной (HNO3) кислот на мрамор (CaCO3). К доске выходят двое учащихся и демонстрационно выполняют опыты: один выполняет, второй – записывает на доске уравнения проделанных химических реакций.
Опыт №1. Получение углекислого газа и изучение его свойств.
Заранее заправленный прибор для получения газа (кусочки мрамора, раствор соляной кислоты) – открыть зажим на шланге, и собирать СО2 методом вытеснения воздуха из химического стакана, т.к. он тяжелее воздуха, но не способом вытеснения воды, хотя он тяжелее воды – почему? (хорошо растворяется в воде).
Затем проверить, горит ли в нем тлеющая лучинка – сделать вывод (СО2 не поддерживает горения, тлеющая лучинка гаснет).
Опыт №2. Пропустить образующийся углекислый газ через прозрачный раствор известковой воды – известковая вода мутнеет – это способ распознавания углекислого газа.
На доске – уравнения реакций:
![]()
мрамор
![]()
известковая
вода
В промышленности большие количества углекислого газа получают обжигом известняка:
![]()
известняк
По химическим свойствам это – типичный кислотный оксид, поэтому для него характерны все реакции кислотных оксидов:
![]() , (равновесие
смещено влево).
, (равновесие
смещено влево).
При добавлении лакмуса – синий лакмус краснеет, значит образуется кислота (хотя и слабая).
![]()
основной
оксид
![]()
щелочь
![]() , СО2 –
окислитель, С – восстановитель.
, СО2 –
окислитель, С – восстановитель.
Почему СО2 – окислитель? (проблемный вопрос).
Ответ. СО2 может быть только окислителем, т.к. степень окисления у углерода (+4), все электроны отданы, и углерод углекислого газа может принимать электроны, выступая в роли окислителя.
Далее короткое сообщение учащегося об углекислом газе (Приложение 3).
III. Заключение.
Итак, на уроке Вы познакомились со строением молекул и свойствами двух оксидов углерода – СО и СО2, их нахождением в природе, физиологическим действием на живой организм.
IV. Домашнее задание.
Заранее написано на части доски:
1) § 29, с. 134-136 (до угольной кислоты)
2) В тетрадях написать уравнения химических реакций к одной из двух цепочек превращений (по выбору):
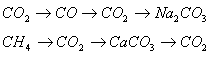
V. Подведение итогов работы на уроке.
Выставление оценок учащимся за работу у доски (2), за сообщения об алмазе и графите (2), за демонстрацию опыта и записи уравнений реакций на доске (2), за сообщения об СО и СО2 (2).
VI. Дополнительное домашнее задание.
Предложить одному из учащихся подготовить к следующему уроку сообщение о “парниковом эффекте” (по желанию).
Литература для учителя:
1. О.С. Габриелян. Химия. Учебник. 9 класс. – М.,
Дрофа, 2002
2. О.С. Габриелян, И.Г. Остроумов. Настольная книга
учителя. Химия. 9 класс. – М., Дрофа, 2002
3. Я иду на урок химии. Книга для учителя. 8-11
классы. – М., Первое Сентября, 2000
4. Журнал “Химия. Методика преподавания в школе.
2001. №4” (с.58-60).
5. Журнал “Химия в школе”. 2004. №5 (с. 22-24).