Цели урока: усвоить понятие о кристаллических решетках и ее видах; влияния вида решетки на свойства веществ.
Личная значимость изучаемого для школьника: зная состав и строения веществ, можно прогнозировать их свойства для дальнейшего использования.
Методы обучения: проблемный, модульный, метод аналогий, частично-поисковый
Форма организации: вводный урок, работа в группах.
Задачи:
- Образовательные: Сформировать у учащихся понятие кристаллическая решетка; познакомить с кристаллическим и аморфным состоянием тел; Ознакомить с типами кристаллических решеток; рассмотреть влияние химической связи на тип кристаллической решетки; на примерах показать связь между данным типом кристаллической решетки и физическими, химическими свойствами веществ; актуализировать и расширить знания учащихся о понятии аллотропии.
- Развивающие: формировать умения сравнивать, вычленять в изученном существенное; устанавливать причинно-следственные связи; делать обобщения; связно излагать и доказывать учебный материал; применять, выполнять и систематизировать полученные знания; пользоваться модульными карточками.
- Воспитывающие: воспитывать умения организовать свой учебный труд; соблюдать правила работы в коллективе, на рабочем месте; развитие нравственных качеств.
Понятийный словарь:
Кристаллическая решетка; молекулярная, атомная, ионная, металлическая решетки; кристалл, аморфное вещество; аллотропные модификации.
Оборудование: Для демонстрации: Модели кристаллических решеток разных типов. Образцы кристаллических и аморфных тел.
Модульные карты учащихся. Анкета для рефлексии.
ТИПЫ КРИСТАЛЛИЧЕСКИХ РЕШЕТОК
| УЭ | Учебный материал с указанием заданий | Рук-во | ||||||||||||||||||||||||||||||||||||||
| 1 |
|
3 | ||||||||||||||||||||||||||||||||||||||
| УЭ-0 | Интегрирующая цель: в результате
овладения содержанием модуля вы будете знать: 1) типы кристаллических решеток; 2) их характеристику; 3) свойства веществ в зависимости от типа решетки. уметь: 1) определять тип решетки по химической формуле; 2) определять по решетки свойства вещества. |
Внимательно прочитайте цели данного модуля | ||||||||||||||||||||||||||||||||||||||
| УЭ-1 | Цель: должны освоить понятие
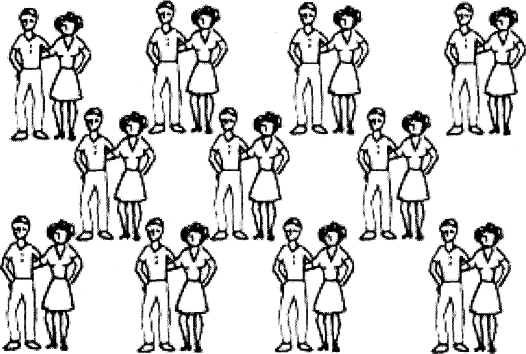
кристаллическая решетка, виды решеток Справка: 1. Молекулярная кристаллическая решетка 1. Характеристика У веществ с молекулярным строением в узлах кристаллической решетки находятся молекулы с прочными ковалентными связями между атомами. В то же время отдельные молекулы взаимосвязаны гораздо слабее, что делает молекулярный кристалл довольно непрочным. 2. Аналогия Можно уподобить эту структуру группе семейных пар (рис. 1). В каждой паре супругов связывают прочные узы брака (подобно прочной связи атомов внутри молекулы), а вот отношения между парами носят поверхностный характер: они могут дружить семьями, испытывать дружеские чувства, но довольно свободно могут обойтись и друг без друга.
Рис. 1 Группа супружеских пар (аналогия молекулярного кристалла) 2. Ионная кристаллическая решетка 1. Характеристика У веществ с ионной решеткой в узлах расположены разноименно заряженные ионы, удерживаемые силами электростатич. притяжения. 2. Аналогия Уподобим эту структуру группе расположенных в шахматном порядке мужчин и женщин (рис. 2). Пусть мужчины символизируют катионы, а женщины - анионы. Тогда каждый человек оказывается в зоне действия обаяния окружающих его представителей противоположного пола, к которым он (она) в силу закона притяжения противоположностей испытывает интерес. Интерес этот одинаково выражен во всех направлениях, поскольку на рисунке - холостые мужчины и незамужние женщины. Этим и объясняется повышенная прочность ионного кристалла.
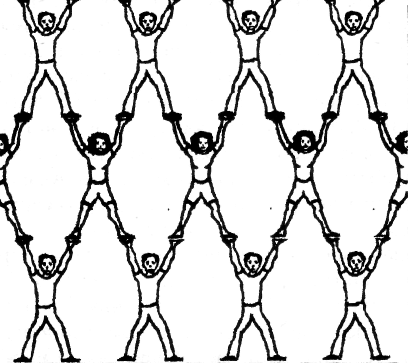
Рис. 2. Романтическая сила влечения (аналогия ионного кристалла) 3. Атомная кристаллическая решетка 1. Характеристика В узлах атомной кристаллической решетки находятся атомы, связанные прочными ковалентными связями в протяженную пространственную сеть. В этом случае структура отличается таким внутренним единством, что можно сказать, что весь кристалл представляет одну молекулу. 2. Аналогия. Представим эту структуру виде гимнастической пирамиды (рис. 3).
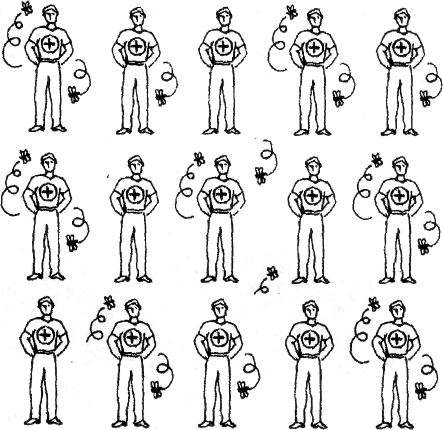
Рис. 3. Гимнастическая пирамида (аналогия атомного кристалла) Каждый гимнаст на ней символизирует атом углерода, связанный четырьмя ковалентными связями с соседними атомами. Целостность структуры поддерживается исключительно благодаря усилиям каждого из гимнастов. Таким образом, зависимость людей друг от друга в этой ситуации больше, чем на любом из предыдущих рисунков (это и является аналогией повышенной прочности атомного кристалла). Пирамида (см. рис. 3) демонстрирует также высокую взаимосвязанность узлов атомной кристаллической решетки: стоит одному из гимнастов ослабить только одну связку, и вся структура может рухнуть. 4. Металлическая кристаллическая решетка 1. Характеристика Этим типом кристаллической решетки обладают металлы с металлической химической связью. 2. Аналогия Для иллюстрации строения металлов в твердом состоянии найдена особенно экстравагантная аналогия. Группа мужчин (рис. 4) изображает катионы металлов (узлы металлической кристаллической решетки). Все пространство между ними заполнено летающими пчелами (это, понятно, свободные электроны). Рисунок убедительно иллюстрирует силы, удерживающие одноименно заряженные катионы в узлах решетки: при всем желании деваться некуда – всюду пчелы! Рис. 4. Среди пчел (аналогия структуры металла)
|
Вниматель-но прочитайте характеристику, представьте аналогию. | ||||||||||||||||||||||||||||||||||||||
| УЭ-3 | Цель: вы должны предположить
влияние типа кристаллической решетки на
свойства веществ. Задание для работы в группе: 1 группа 1. Какие должны быть отличительные свойства веществ с молекул. реш. ? 2. Каково их агрегатное состояние? 3. Приведите примеры веществ с молекулярной кристаллической решеткой? 2 группа 1. Какие должны быть отличительные свойства веществ с ионной решет. ? 2. Каково их агрегатное состояние? 3. Приведите примеры веществ с ионной кристаллической решеткой? 3 группа 1. Какие должны быть отличительные свойства веществ с атомной решет. ? 2. Каково их агрегатное состояние? 3. Приведите примеры веществ с атомной кристаллической решеткой? 4 группа 1. Какие должны быть отличительные свойства веществ с металл. решет. ? 2. Каково их агрегатное состояние? 3. Приведите примеры веществ с металлической решеткой? 5 группа Изучив прочитанное, сформулируйте по 1 вопросу каждой группе. |
Внимательно прочитайте вопросы, ответьте на них устно. Возможна запись в тетради. | ||||||||||||||||||||||||||||||||||||||
| УЭ -4 | Цель: проверим ваши знания. 1. Вид частиц в ионной решетке:
2. Характер химической связи в атомной решетке:
3. Прочность связи в молекулярной решетке
4. Агрегатного состояния у веществ с ионной решеткой:
5. Вещества без определенной температуры плавления и закономерного расположения частиц называются:
6. Очень тугоплавкими являются вещества с решеткой:
7. Пластичностью обладают вещества с:
8. Кремний имеет решетку:
9. Щелочи имеют решетку:
10. Вода имеет решетку:
|
Посмотритна цели, которые стояли перед
вами в начале урока. Достигли вы их ? Оцените знания, выполните тест. За правиль ответ-1 балл. Прослушай правильные ответы. Поставьте себеоценку. Проанали зируйте причину ваших ошибок(если таковые имеются) 9 отв. - 5 7 отв. - 4 5 отв. - 3 |
||||||||||||||||||||||||||||||||||||||
| Д З | 1. Прочитать 16. 1 – 16. 4 2. Задание 16. 1 3, 6-10 3. Задание 16. 2 4-6 4. По желанию творческое задание: смоделировать кристаллическую решетку любого вещества и дать ей полную характеристику. |
Зад 2 для уч-ся, пол за тест ниже 4. Получив 4 и 5 выполн и еще задание 3 |
ХОД УРОКА
Эпиграф к уроку “Познать сущее нельзя извне, можно только изнутри”
Бердяев Н. , философ
1. Организационный момент
Уважаемые учащиеся! Сегодня мы открываем первую страницу курса Химии 9 класса. С чего начать? Ведь мы уже достаточно много знаем о веществах, их свойствах. Так разнообразен мир веществ. В чем же причина? На эти и многие другие вопросы ответит тема 1 “Строение вещества”.
2. Переход к изучению новой темы
Химия – это наука о веществах, их свойствах и превращениях.
- А от чего зависят эти свойства? От строения.
Обратите внимание на эпиграф к нашему уроку, и сформулируйте проблему, которую необходимо решить на этом уроке.
- Проблема Как строение веществ влияет на их свойства.
Для решения этой проблемы нам необходимо выполнить главную задачу - познакомиться с понятием “кристаллическая решетка” и ее видами.
Записываем тему урока
3. Изучение новой темы
1. АГРЕГАТНОЕ СОСТОЯНИЕ ВЕЩЕСТВ
Демонстр. – Продемонстрируем вещества: вода, лед, пар. Во всех случаях это Н2О. Но все они отличаются. Чем? Агрегатным состоянием. Известны 3 агрегатных состояния вещества: твердое, жидкое и газообразное.
- Кратко характеризуем каждое из состояний.
- Вспомним агрегатные состояния вещества (демонстрирую рисунки, которые напомнят учащимся как мы проходили эту тему используя метод аналогий)
Твердые вещества обладают постоянством формы и объема.
Жидкие вещества, имея объем, принимают форму сосуда, в котором они находятся.
Газообразные вещества не имеют собственной поверхности и собственного объема.
Практически любое вещество можно получить в каком-либо виде. Надо только создать соответствующие условия. Например вода при обычных условиях находится в жидком состоянии, понизив температуру ниже 0 С, мы получим воду в твердом, кристаллическом состоянии. Повысив температуру до 100 С, мы переводим жидкую воду в газообразное состояние. Металлы, находящиеся в твердом состоянии при нормальных условиях, при нагревании начинают размягчаться, и при определенных температурах начинают плавиться, т. е. переходить в жидкое состояние. При дальнейшем нагревании до температуры кипения металлы начинают испаряться, т. е. переходить в газообразное состояние. Любой газ можно перевести в жидкое или твердое состояние, понизив температуру. Примеры
Каковы особенности твердого состояния по сравнению с жидким и газообразным?
1) расстояние между частицами в твердых веществах меньше, чем в газах
2) межатомные и межмолекулярные взаимодействия в твердых веществах гораздо сильнее
3) четкое расположение частиц, образующих вещество.
Эти частицы находятся в строго определенных точках пространства, называемые узлами (модель) Если мысленно соединить эти узлы прямыми линиями, образуется пространственный каркас, называемый кристаллической решеткой.
Кристаллической решеткой называют совокупность точек пространства, в которых располагаются частицы, образуя кристалл. (записывают в тетрадь)
Демонстр. Продемонстрируем три кристаллических вещества: кварц, хлорид натрия, серу и следуем их в простых опытах. Сравним свойства этих соединений. Ударим молоточком по куску кварца, серы и кристаллам хлорида натрия.
- Одинаковы ли по прочности эти соединения? Такой простой эксперимент показывает хрупкость кристаллов серы и хлорида натрия и устойчивость к удару оксида кремния.
Демонстр. Далее исследуем еще одно свойство: температуру плавления. Нагреем взятые вещества на огне горелки (спиртовки). Мы видим, что при нагревании на спиртовке (температура пламени до 300 С) хлорид натрия и оксид кремния не изменяются, т. е. их Т плав гораздо выше. Да. Температуры плавления оксида кремния 1610 С, серы 119 С, соли 801 С.
- О каком строение этих веществ говорит температура плавления?
О немолекулярном для хлорида натрия и оксида кремния, о молекулярном для серы.
- Значит, от чего зависит данное свойство вещества?
От того, какие частицы входят в состав вещества.
- А какие частицы образуют вещества молекулярного строения, а какие немолекулярного?
Молекулярные – молекулы, немолекулярные - атомы, ионы.
В соответствии с типом частиц, располагающихся в узлах решетки, различают молекулярные, атомные, ионные и металлические кристаллические решетки (схема на доске). Таким образом, в узлах молекулярных решеток находятся молекулы, в ионных решетках - ионы, в атомных - атомы.
2. ТИПЫ КРИССТАЛЛИЧЕСКИХ РЕШЕТОК
(лабораторная работа в группах по модульным карточкам)
Задание
- У каждого на парте лежит инструктивная модульная карточка для изучения типов кристаллической решетки. Ознакомьтесь с каждой его частью и выполните необходимые задания в группе. Время выполнения 10 минут.
По истечении 10 минут проводим обсуждение 3 учебного элемента
В качестве вывода записываем в тетрадь основные признаки кристаллических решеток. Демонстр. – Вам предложены (группе) твердые вещества: жевательная резинка, пластмасса, стекло, шоколад, пластилин, железо, кварц, поваренная соль.
- Разделите эти вещества на 2 группы и перечислите их.
- По какому принципу были они разделены. Первая группа может размягчаться, переходить в текучее состояние, при ударе образуют осколки неопределенной формы. У веществ, второй группы видны кристаллы, при ударе они образуют осколки определенной формы.
Таким образом все твердые вещества могут быть кристаллическими и аморфными (схема на доске). Особенность аморфных веществ – нет определенной Т плавл, они размягчаются, бесформенные, закономерного расположения частиц не наблюдается.
Приводя примеры веществ, вы в основном упоминали твердые и жидкие вещества
- А бывают ли кристаллические структуры у газообразных веществ?
(кто был внимателен в начале урока,смогут легко ответить на этот вопрос)
3. АЛЛОТРОПНЫЕ МОДИФИКАЦИИ
Внутренняя упорядоченность структуры проявляется во внешней форме кристалла (см. рис. 16. 2 в учебнике) Обратите внимание на рисунок алмаза и графита.
- Какой химический элемент образует эти вещества? Углерод
Некоторые вещества в зависимости от условий их получения могут образовывать различные кристаллические формы, которые называются аллотропными модификациями ( Вспомните, аллотропные модификации каких химических элементов мы уже проходили в 8 классе)
Задание Найдите на рис 16. 1 аллотропные модификации для железа, углерода. Видите, что крист. решетки аллотропных модификаций отличаются, значит и отличаются и их свойства.
Задание Предположите, какие должны быть физические свойства алмаза и графита? Алмаз –твердый, тугоплавкий, эл. ток не проводит; графит- мягкий, т. плавления меньше, электропров.
Но у аллотропных модификаций в связи с разными кристаллическими решетками отличаются не только физические, но и химические свойства. Т. к в кристаллической структуре имеются длинные химические связи, они быстро разорвутся, значит более реакционноспособным будет графит. В кристаллической структуре алмаза все связи одинаковые, близко расположенные, значит он менее реакционноспособный и тверже графита.
- Рассмотрим аллотропные модификации фосфора (см таблицу на доске)
- Чем отличаются кристаллические решетки. Предположите химическую активность этих веществ. Красный – атомная, белый молекулярная (см. химич активность в учебнике с. 13)
Таким образом Вернемся к началу урока и повторим ту проблему, которую мы ставили перед собой. Сделайте вывод.
Вывод: Свойства веществ зависят от строения их кристаллической решетки. Если известно строение веществ, то можно предсказать их свойства, и наоборот, если известны свойства, то можно определить их строение.
3. ЗАКРЕПЛЕНИЕ Посмотрите учебный модуль 4 и выполните необходимые задания.
Время выполнения 5 минут.
Ответы: 1-а, 2-б, 3-в, 4-а, 5-б, 6-в, 7-а, 8-б, 9-в, 10-а. или абв-абв-абв-а
4. ДОМАШНЕЕ ЗАДАНИЕ Посмотрите учебный модуль 5.
5. РЕФЛЕКСИЯ (у каждого, после заполнения учитель собирает)
Проведи оценку по 5 балльной системе __________________(Ф. И. )
а) внимание________________
б) дисциплина_________________
в) степень усвоение материала ________________
г) работа на занятии ____________________
д) оценка за занятие себе _______________
е) оценка за занятие учителю_________