Введение
Как часто мы видим, что в качестве основных законов природы большинство ребят на вопрос учителя физики перечисляют законы, которые им встречались на этих уроках, а на вопрос учителя химии перечисляют законы химии.
Они не понимают, что к основным законам природы следует отнести наиболее общие законы, изучаемые различными науками.
Проведение бинарных уроков позволяет решить эту проблему, ликвидировать однобокость в знаниях учащихся.
Безусловно, бинарных урок имеет много известных достоинств; и не случайно все шире и шире применяется в педагогической практике .
И эти строки М.Агилер прекрасно отражают неразрывную связь естественных наук:
“О, физика – наука из наук!
Все впереди!
Как мало за плечами!
Пусть химия нам будет вместо рук;
Пусть станет математика очами.
НЕ разлучайте этих трех сестер
Познания всего в подлунном мире,
Тогда лишь будет ум и глаз остер,
И знание человеческое шире.”
Бинарный урок по физике-химии
ТЕМА “Электрический ток в проводниках”
1. Основная цель.
1.1. Работа урока на резвитие умений умственной деятельности:
- умение слушать и отвечать на всех этапах урока.
- умение выделить главное, обобщать.
- умение нестандартно мыслить.
1. 2. Работа урока на развитие личностных качеств студента и его мировоззрение;
- осмысление различных понятий, применение данного материала в химии, физике полупроводников.
2. План урока.
2.1. Мотивация учебной деятельности.
2.2. Разминка.
2.3. Изложение нового материала.
2.4. Подведение итогов урока.
2.5. Просмотр кинофильма “Применение электролиза”.
Оборудование: источники постоянного и переменного токов, пять приборов для электролиза, дистиллированная вода, сахар, поваренная соль, раствор HCL, CuSO4, угольные и медные электроды, лампа накаливания, соединительные провода, таблицы, тесты, схемы, киноаппарат.
Содержание урока и методические указания
I. Мотивация учебной деятельности.
Изучение тока в электролитах привели английского физика Деви к открытию ряда новых химических элементов: натрия, калия, кальция. Применив электролиз воды и щелочи, Деви впервые показал, что вода и щелочь не являются простыми веществами, как их считали в то время.
В настоящее время путем электролиза получают алюминий (это единственный промышленный способ его получения), химически чистые металлы, производят никелирование, хромирование, золочение и другие технические процессы.
Задача нашего урока:
1. Повторить “Эл.ток в металлах”.
2. Изучить физическую природу электрического тока в электролитах.
3. Вывести законы электролита на основе электронной теории.
4. Познакомить учащихся с техническим применением электролиза.
5. Подтвердить электронную теорию строения вещества и теорию электролитической диссоциации.
Разминка – 16 мин. Проходит в 2 этапа.
1. Психологический тест.
2. Тестирование по теме: “Термоэлектричество”.
Изложение, объяснение нового материала.
Постановка опытов (физика).
Объяснение (химия) электролитической диссоциации и электролиза.
Законы электролиза.
Определение заряда одновалентного иона.
Техническое применение электролиза. (самостоятельно; просмотр кинофильма).
Здравствуйте. Садитесь.
Ребята, однажды великого мыслителя Сократа спросили о том, что, по его мнению, легче всего в жизни? Он ответил, что легче всего – поучать других, а труднее – познать самого себя.
На уроках физики, химии мы говорим о познании природы. Но сегодня, прежде чем изучать физико-химические явления, давайте заглянем “в себя”. Как мы воспринимаем окружающий мир? Как художники или мыслители?
На уроке у нас присутствуют гости. Им тоже интересно заглянуть “в себя”, да и узнать, к кому же они пришли в гости.
Проведем небольшой психологический тест.
1. Переплетите пальцы рук.
Большой палец правой или левой руки оказался у вса вверху? Результат запишите буквами “Л” или “П”.
2. Определите ведущий глаз.
Для этого возьмите лист бумаги с небольшим отверстием. Расположите его на расстоянии примерно на 20 см от глаз, посмотрите двумя глазами через отверстие на авторучку, которая находится в вытянутой руке. А затем поочередно закрывайте левый и правый глаз. Вы увидите ручку только ведущим глазом. Результат также запишите.
3. Скрестите руки на груди. (“поза Наполеона”).
Какая рука сверху? Опять запишите результат.
4. Поапплодируйте. Какая рука сверху? Результат запишите.
Подведем итоги.
Учитывая, что результат “ЛЛЛЛ” соответствует художественному типу личности, а “ПППП” - типу мышления.
(не углубляясь в психологию, замечу, что эти различия связаны с функциональной ассиметрией мозга человека; у “художников” более развито левое полушарие и логическое мышление).
Какой же тип мышления преобладает у учащихся вашего класса? Итак, в группе ОМ1-97 несколько “художников”, несколько “мыслителей”, а большинство ребят – гармонично развитые личности, которым свойственно как логическое, так и образное мышление.
Вот и познакомились: вы с собой, а я чуть больше – с вами.
Сегодня у нас блок № 5 контрольная точка – тест – 8 мин.
А теперь можно переходить к познанию внешнего мира. Закончили эл.ток в металлах. Переходим к следующему блоку “эл. в различных средах”.
Тема урока:
Электрический ток в электролитах.Перед этой темой мы закончили тему: “Эл. ток в металлах”.
Основное содержание темы связано со знаниями, которые вы получаете в курсе химии. Поэтому ряд вопросов из темы “Эл. ток в электролитах” на уроке физики рассматривается в порядке повторения и установления связи с вашими знаниями по химии.
Цель урока: изучить природу тока в электролитах, закономерности, возникающие в электролитах при протекании тока, электролиз и его применение. В процессе урока вам предстоит повторить явление диссоциации ионов, рекомбинации ионов и т.д.
1. Рассмотрим проводимости некоторых веществ.
Начнем с сахара. Составим цепь из электролитической ванны, где находится сахар, опускаем в них металлические электроды, через лампу соединяем с сетью.
Лампа не горит. Вывод: сухой сахар не проводит эл.ток.
2. Заменим сахар на соль, тока опять нет.
3. А проводит ли ток дистиллированная вода. НЕТ. Значит, дистиллированная вода является диэлектриком. И там нет свободных носителей заряда.
4. Растворим немного сахара в дистиллированной воде. И вновь тока нет.
5. А теперь растворим соль в воде. Лампа загорелась. Есть ток в цепи! Видимо, появились свободные носители заряда. Значит, сухая соль не проводит эл. ток, а раствор соли становится проводником.
6. Проделаем еще один опыт.
В дистиллированную воду капнем немного соли HCl. Замкнем цепь. Лампа загорелась. Кислоты тоже являются проводниками.
Электролитическая диссоциация
Данные опытов записаны в таблице
| Вещество | Проводимость тока |
| Кристаллический сахар | Не проводит |
| Кристаллическая соль | Не проводит |
| Дистиллированная вода | Не проводит |
| Раствор сахара | Не проводит |
| Раствор соли | Проводит |
| Раствор кислоты | Проводит |
| Питьевая вода | Проводит |
Электрический ток – это направленное движение заряженных частиц. То есть проводимость вещества можно объяснить:
1) Наличием заряда
2) Способностью двигаться
С этой точки зрения и рассмотрим данные опыта.
Кристаллические сахар и соль не проводят ток, так как нет подвижных частиц. Они связаны в кристаллическую решетку. Дистиллированная вода хотя имеет подвижные частицы, но это молекулы, то есть частицы незаряженные.
Раствор сахара не проводит ток, как кристаллическая решетка распадается на молекулы, то есть на незаряженные частицы.
Раствор соли и кислоты проводит электрический ток, так как соблюдаются два условия: заряд и подвижность частиц. Происходит электролитическая диссоциация веществ:
![]()
Предлагается показать диссоциацию веществ, используя диэлектрический материал.
Итак: процесс распада вещества на ионы при растворении или расплавлении называют электролитической диссоциацией.
Электролиты – это вещества, растворы или расплавы которых проводят электрический ток. Рассмотрим, что происходит в электролитах при прохождении электрического тока.
При расплавлении хлорида натрия получаются ионы натрия и хлора. При прохождении тока они начинают двигаться самостоятельно: ионы натрия к катоду, ионы хлора – к аноду.
![]()
На катоде протекает процесс: ![]()
На аноде протекает процесс: ![]()
Под де йствием электрического тока происходит превращение вещества, такое химическое превращение вещества и выделение его на электродах под действием тока называют электролизом.
![]()
Используя дидактический материал, предлагается показать процессы, протекающие на катоде и аноде, и процесс электролиза.
Дидактический материал.
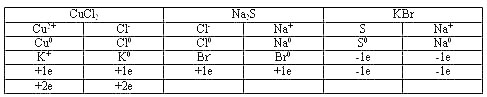
А теперь Татьяна Николаевна вместе с вами рассмотрит причины этих явлений.
Итак, с Татьяной Николавевой вы рассмотрели качественное описание явления электролиза, а теперь перейдем к количественным закономерностям.
Химические действия эл. тока впервые были открыты в 1800г. И только в 1833-34 гг М. Фарадеем были установлены законы электролиза. Законы? Значит, не один.
7. Проведем опыт с раствором медного купороса (CuSO4)
Рассмотрим первый закон электролиза. Собираем цепь и раствор CuSO4 опускаем угольные стержни (как к угольному стержню припаять медный провод).
Первый закон устанавливает зависимость массы вещества, выделенного при электролизе от величины заряда, прошедшего через электролит. Опыты с различными электролитами показывают, что m~ q.
Чтобы знак пропорциональности заменить знаком равенства, поставим коэффициент пропорциональности.
1883г. m~ kq – это и есть математическая запись 1 закона электролиза если q=It, m=k.I.t
От чего, по вашему, зависит еще m, кроме q? От рода вещества.
![]() , что
электрохимический эквивалент – это величина,
характеризующая зависимость массы вещества,
выделяющего при электролизе от рода вещества.
, что
электрохимический эквивалент – это величина,
характеризующая зависимость массы вещества,
выделяющего при электролизе от рода вещества.
При решении задач значение k берем из таблицы, табл №17. стр. 316.
Откройте задачники, посмотрите на таблицу, найдите k для золота =6,81.10-7кг/кл
k Cu=3,294.10-7кг/кл
k Zn=3,388.10-7кг/кл
И скажите, какого вещества на катоде выделится больше, если через электролизы этих веществ протекает одинаковый ток в течение одного и того же времени (золото).
Посмотрим, что же происходит в нашем опыте? Вытаскиваем электроды из раствора, отключаем цепь. Если вначале катод был чуть-чуть розовый, то теперь уже цвет стал насыщенным. Итак, вещество при электролизе откладывается на катоде (электрод, соединенный с минусовой клеммой источника тока).
Как к угольному стержню припаять медный привод?
Перейдем ко второму закону электролиза (1834 г).
Он устанавливает зависимость между его электрохимическим эквивалентом и химическим эквивалентом.
Дадим определение химическому эквиваленту. Вспомним, что масса m одного моля ионов в граммах равна относительной молекулярной массе одного иона.
![]()
Частное от деления молярной массы ионов на их
валентность ![]() называют химическим эквивалентом этих ионов.
называют химическим эквивалентом этих ионов. ![]()
В результате этих опытов Фарадей нашел, что для выделения на электроде одного химического эквивалента ионов любого вида нужно пропустить через электролит одинаковое количество электричества. Это количество электричества F принято называть числом Фарадея или постоянной Фарадея.
![]() т.е. F –
общий заряд всех ионов, составляющих один
химический эквивалент.
т.е. F –
общий заряд всех ионов, составляющих один
химический эквивалент.
Опыты Фарадея устанавливают: k~ x; k~ m /n;
![]() -
математическая запись II закона электролиза.
-
математическая запись II закона электролиза.
Если при электролизе выделилось на электроде m
кг вещества, а химический эквивалент составляет ![]() кг/моль, то
отношение m кг m /n выражает число выделенных
химических эквивалентов.
кг/моль, то
отношение m кг m /n выражает число выделенных
химических эквивалентов.
Далее, если при этом через раствор прошло q кулонов электричества, а для выделения одного химического эквивалента необходимо F кулонов, то отношение q к F тоже есть число химических эквивалентов, выделенных при электролизе.
 матем.
запись объедин. закона электролиза.
матем.
запись объедин. закона электролиза.
Используя законы электролиза, можно найти заряд одновалентного иона, т.е. заряд электрона.
Вывод о существовании в природе элементарного электрического заряда был сделан Германом Людвигом Фердинандом Гельмгольцем в 1881 г.
Если валентность ионов n=1, то химический
эквивалент ![]() ,
т.е. в молярной массе ионов m , а заряд каждого иона
численно равна e.
,
т.е. в молярной массе ионов m , а заряд каждого иона
численно равна e.
Вспомним, что число ионов в одном моле равно
числу Авогадро NА , поэтому, если общий
заряд всех ионов моля равен F, то ![]() . Подставим числовые
значения:
. Подставим числовые
значения: ![]()
E=1,6.10-19кл
Это значение заряда электрона хорошо совпадает с результатом опытов Милликена (1910г) – амер. ученого, что подтверждает электроную теорию строения вещества и теорию электролитической диссоциации.
Рассмотрим теперь применение электролиза.
Самостоятельно: это и электроэкстракция и рафинирование, гальванопластика, гальваностегия, электрополировка, получение тяжелой воды, электролитические конденсаторы (материал раздается ребятам).
Китайский философ Конфуций как-то сказал словно для нас с вами: (перед задачами)
“Хорошо обладать природным дарованием, но упражнения, друзья, дают нам больше, чем природное дарование”.
Русская пословица гласит: “Учиться всегда пригодится”.
Закрепление: как к угольному стержню пирпаять медный провод?
а) Решение задач
б) Фронтальный опрос
1. Могут ли при диссоциации образоваться ионы одного какого-нибудь знака? Почему? (нет, потому что диссоциирующая молекула состоит из ионов разных знаков).
2. Почему нельзя прикасаться к неизолированным электрическим проводам голыми руками? (Влага на руках всегда содержит раствор различных солей и является электролитом. Поэтому она создает хороший контакт между проводами и кожей).
3. В раствор медного купороса опущены 2 угольных стержня, на одном из которых отлагается медь. Почему наиболее толстый слой меди получается на той части его поверхности, которая обращена к другому углу? (Здесь наибольшая плотность тока).
Первую задачу решаю я.
№1 стр.268.
Определить сопротивление р-ра серной кислоты, если известно, что при прохождении тока за 2 ч. выделилось 0,72 г водорода. Мощность, затраченная на нагревание электролита, 100 Вт.
t=2 ч t=7200с ![]()
m=0,72г m=0,72.10-3кг ![]()
p=100Вт ![]()

k=1,045.10-8кг/кл

R-?
№149 стр. 133
При пропускании через электролит тока 1,5 А за 5 мин на катоде выделились 137 мг вещества. Какое это вещество?
I = 1,5А Cu m=kIt
t = 5 мин t=300 с ![]()
m = 137мг m=137.10-6 ![]()
k - ? Это двухвалентный никель
№5 стр 270
Сколько никеля, m которого = 58,71.10-3 кг/моль, валент.2, выделяет ток 10 А, за 1 ч.
m =58,71.10-3кг/моль Исходим из объединенного закона Фарадея.
n = 2 ![]()
I = 10А ![]()
t = 3600 с
![]()
m - ?
Самостоятельно: 14,15.
Амперметр, включенный в цепь с электролитической ванной, показал 0,2А. Правильно ли показание амперметра, если за 25 мин на катоде выделилось 250 мг серебра?
№14.30
j = 0,7 Cu
h = 0,05
j = I/S
m = k I t
V = m/p
m = p V
p V = k I t
p h S = k j S t
h = V/S
I = j S
m = k I t
0,7.102А/мг
t - ? 0,058.10-3м

При серебрении изделий использовался ток с плотностью 0,7А/см2. Сколько времени необходимо пропускать ток, чтобы образовался слой серебра толщиной 0,05 мм.
№10 стр 272ц.
Определить валентность никеля, если известно, что за 2ч никелирования в 100 параллельно соединенных ваннах с сопротивлением 30м каждая выделилось 430г никеля. Электролиз проводился при напряжении 6В.
t = 2ч= 7200 с Для определения валентности никеля запишем
z = 100 объединенный закон Фарадея
R = 30 м ![]()
![]()
m = 430 г = 0,43 кг ![]()
![]()
U = 6 В ![]()
m = 58,71.10-3 кг/моль
F=9,65.107 кг
На дом: № 14.17; № 14.23; № 14.24. Конспект.
Сосавить схему – области применения электролиза. У кого будет более интересная, полная, правильная – дополнительный балл.
Урок закончен. Спасибо!