Тема: Реакции замещения.
Цель: дать понятие о сущности реакций замещения.
ТДЦ
Образовательные:
– продолжить формирование умения записывать уравнения химических реакций;
– экспериментально установить какие реакции являются реакциями замещения;
– начать формирование умения предсказывать продукты реакций замещения;
– дать первоначальное понятие об электрохимическом ряде напряжений металлов.
Развивающие:
– развивать когнитивную сферу учащихся;
– развивать общеучебные умения и навыки: работа по плану; работа с учебником;
– сформировать умение пользоваться лабораторным оборудованием и реактивами;
– развивать мыслительные операции учащихся: сравнение, анализ, синтез;
– развивать умение анализировать результаты опыта;
– развивать умение делать самостоятельные выводы;
– развивать внимание учащихся и его свойства: объём внимания, концентрация внимания, распределение внимания; развивать разные виды памяти учащихся: механическую, слуховую и пр.
Воспитательные:
– прививать культуру умственного труда и сотрудничества;
– воспитывать дисциплинированность учащихся;
– воспитывать коллективизм;
– воспитывать чувство ответственности;
– способствовать созданию благоприятного психо-эмоционального климата на уроке.
Тип урока: урок усвоения новых знаний.
Методы обучения:
– словесные (рассказ, объяснение, беседа);
– демонстрационные (опыты);
– лабораторные;
– иллюстративные (схемы химических реакций);
– частично-поисковый, проблемный (проблемная ситуация).
ФОПД: фронтальная, индивидуально – обособленная, групповая (динамические группы).
Технологии: элементы технологии “Сотрудничества” и “Проблемного обучения”.
Оборудование и реактивы:
– Zn, Mg, Al, Си, Li, Na, Ca – металлы;
– H Cl, H2SO4, Си SO4, фенолфталеин – растворы.
Демонстрационный эксперимент:
1) Взаимодействие щелочных Me с Н2О;
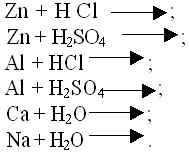
Лабораторный эксперимент:
I. Opr момент. Вступление. Оценка эмоционального состояния.
II. Повторение изученного, актуализация знаний.
Крестики – нолики: (на доске)
| H2SO4 | Li ОН | Zn CI2 |
| Al2 (SO4)3 | НС1 | Na OH |
| AlCl3 | Са (ОН)2 | HNO3 |
| НCl | Li ОН | Cu (NO3)2 |
| NaOH | H2SO4 | A12(SO4)3 |
| HNO3 | Са (ОН)2 | ZnCl2 |
| НС1 | А1С13 | FeSO4 |
| Са (ОН)2 | Li ОН | NaOH |
| Н2О | ZnCl2 | Cu (NO3)2 |
Работа в парах (взаимопроверка): 2 мин.
Составьте формулы (на листочках через копирку):
| I ряд | II ряд | III ряд |
| Хлорид Zn | Гидроксид Li | Сульфат Fe (II) |
| Сульфат Al | Гидроксид Na | Нитрат Cu (II) |
| Хлорид Al | Гидроксид Ca |
Один листочек сдайте мне, другой отдайте соседу, для проверки – 1 мин.
Проверяем вслух.
Третий лишний:
III. Изучение новой темы.
I. Понятие о реакциях замещения на примере взаимодействия кислот с металлами.
Учитель начинает объяснение с того, что рассказывает об открытии водорода Генри Кавендишем (1766 год) и предлагает посмотреть опыт. В раствор опускается гранула (нужно сразу же объяснить это новое понятие – “зёрнышко”, “кусочек”) цинка – начинается выделение пузырьков газа, который учитель собирает в перевёрнутую пробирку большего диаметра.
Объясняется, что этот способ называется способом вытеснения воздуха, а пробирка перевёрнута потому, что водород легче воздуха.
Затем учитель показывает способ распознавания водорода в двух модификациях:
1) если он собирал Н2 в перевёрнутую пробирку, то при поднесении к ней горящей спички слышен характерный “лающий” взрыв – значит, собран водород в смеси с воздухом – не чистый газ;
2) если же спичка подносится к самой пробирке, где идёт реакция, которую учитель предварительно прикрыл большим пальцем, то слышится “глухой” хлопок – взрыв, значит, собран чистый водород, без примеси воздуха.
Учитель предлагает записать уравнение проделанной реакции: (совместно с ребятами)
![]()
Следовательно, из исходных простого и сложного веществ образовалось новое простое и новое сложное. Такие реакции называются реакциями замещения.
Учитель предлагает ребятам записать аналогичную реакцию для серной кислоты и магния:
![]()
И усложняет для серной кислоты и алюминия:
![]()
Вначале выводится формула соли Al2 (SO4)3
![]()
А затем уравнивается запись – учитель рекомендует при уравнивании реакций с участием солей начинать именно с их формул ( “два алюминия и три остатка”):
![]()
и, наконец, водород:
![]()
II. Электрохимический ряд напряжений металлов и два его правила.
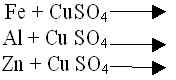
Учитель ставит проблемный вопрос: “А любой ли металл способен вступить в реакцию замещения с кислотой?” – и демонстрирует отсутствие взаимодействия между НСl и Сu. Оказывается, для решения этого вопроса можно воспользоваться ещё одной узаконенной “шпаргалкой” – электрохимическим рядом напряжений металлов (можно на этом этапе давать другое определение – ряд активности – просто и понятно): если металл стоит в этом ряду до водорода, он способен вытеснять его из растворов кислот, если после водорода, то нет. Это и есть первое правило ряда напряжений. Zn, Mg, Al давали реакцию замещения с кислотами (они находятся в ряду напряжений до Н), а Си нет (она после Н). Этот ряд имеет и ещё одно правило, оно тоже относится к реакциям замещения металлов, но только с растворами солей: если металл стоит в ряду напряжений до металла соли, то он способен вытеснить этот металл из раствора его соли (второе правило ряда напряжений). Вспомним правила обращения с лабораторным оборудованием и реактивами, т. Б.
Проводится лабораторный опыт “Замещение меди в растворе сульфата меди (II) железом”, и учащиеся записывают соответствующее уравнение:
![]()
Оформляем результаты лабораторного опыта в виде таблицы.
| Что делали | Что наблюдали |
Вывод:
По аналогии составляется уравнение реакции между алюминием и раствором хлорида меди (II):
2 А1 + 3 Сu С12 = 2 А1 С13 + 3 Сu
Необходимо показать, что здесь положение металла до и после Н уже не имеет значения, важно, чтобы вступающий в реакцию металл предшествовал металлу, образующему соль:
Сu + 2 AG NO3 = 2 Ag + Сu (NO3)2
Серебро на медной монетке получается неэффектное – тёмный налёт, но если его натереть мягкой тряпочкой – монета заблестит, она стала посеребрённой.
В заключение учитель демонстрирует взаимодействие щелочных металлов и Са с водой.
Очень хорошо этот опыт получается с помощью кодоскопа. Чашечки Петри снизу подписываются фломастерами (Li, Na, Ca). В них наливается немного, на донышко, воды, куда добавляется фенолфталеин. Затем в каждую чашечку, стоящую на кодоскопе, опускается по кусочку (со спичечную головку) металла. Реакция проецируется на экран. Записываются соответствующие уравнения реакций:
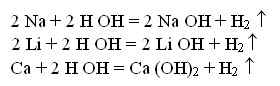
Учащимся напоминается название подгруппы – “щелочные металлы”: теперь этимология названия подтверждена экспериментом.
III. Закрепление.
I уровень: определите типы химических реакций (на доске):
![]()
II уровень: вставьте вместо ? соответствующие химические формулы, расставьте коэффициенты и определите тип химических реакций.
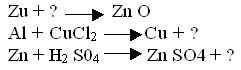
III уровень: запишите химическую реакцию о которой идёт речь:
А) Магний взаимодействует при нагревании с оксидом кремния (IV), с
образованием оксида магния и кремния. Расставьте коэффициенты и укажите тип химической реакции.
Б) Вода взаимодействует с хлором, с образованием хлороводородной кислоты и кислорода. Расставьте коэффициенты и укажите тип химической реакции.
IV.Оценка эмоционального состояния.
Рефлексия.
- Что мы изучали сегодня на уроке – реакции замещения.
- Какие реакции называются реакциями замещения?
- С чего следует начинать расстановку
коэффициентов, если в химической реакции
участвует соль. Ряд активности металлов. - Назовите два правила ряда активности металлов.
- Кто и когда открыл водород? (1766 год, Генри Кавендиш).
V. Оценки и домашнее задание.
Оценки:
Д\З: §27 Реакции замещения.