Цели:
- Привести в систему знания учащихся о периодической системе химических элементов в свете строения атома;
- Раскрыть обобщающее и практическое значение ПЗ и ПСХЭ;
- Продолжить формирование навыков решения задач;
- Осуществлять межпредметную связь с литературой, историей, физикой.
Оборудование: ПСХЭ; ребусы; карточки-задания; химический элементарий – простые вещества бром, магний, олово, медь, фосфор, сера; соединения марганца (раствор перманганата калия), соединение никеля (раствор хлорида никеля); знаки химических элементов - Br, Sn, Ni, P, S, Cu, Mn, Mg.
Оформление кабинета: портрет Д.И.Менделеева; плакаты с высказываниями Д.И.Менделеева о периодическом законе: “Посев научный взойдет для жатвы народной”
“Периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает”
“Свои способности человек может узнать, только попытавшись приложить их”
Сенека.
Ход урока
I. Организационный момент.
- УЧИТЕЛЬ. Прозвенел звонок, и вновь мы с вами, ребята встретились на очередном уроке химии, который мне хотелось бы начать словами А.Чивилихина:
И каждый взгляд ее взлелеяв
Суровым гением своим,
Поведал миру Менделеев
В природе понятое им…
Следовательно, и сегодня мы будем говорить о периодическом законе и периодической системе химических элементов в свете строения атома.
К доске приглашаются 3 ребят для решения задач:
Карточка №1. Дана электронная формула
1S2 2S2 2p6 3S2 3p6 4S2 3d10 4p6
Определить элемент, его положение в ПСХЭ.
Составить формулы: высших оксида и гидроксида, водородного соединение.
С какими веществами реагирует водородное соединение этого элемента:
а) Р2О5 ,
б) NаОН
в) СН2=СН–СН3
г) ВаО.
Составить уравнения возможных химических реакций.
Карточка №2. Гидроксид двух валентного металла массой 14,7г растворили в 100мл раствора соляной кислоты с плотностью 1,1г/мл и массовой долей НCI 10%. Определить металл, изобразить его электронную формулу.
Карточка №3. При разложении 21г карбоната двухвалентного металла выделилось 5,6л СО2 . Определить элемент, составить формулу гидроксида данного элемента, написать формулы двух более основных гидроксидов .
Компьютерное тестирование. Интерактивный курс Открытая химия. Версия 2.5./Автор курса профессор МФТИ В.В.Зеленцов/ Раздел “Самопроверка”. Тема “Электронное строение атомов” /ученики по очереди проводят самопроверку, результаты вносят в отчетный бланк /.
II этап. “Разминка” /задания классу/
УЧИТЕЛЬ:
Пусть зимний день метелями
Не навевает грусть
Таблицу Менделеева
Я знаю наизусть…
Без применения ПСХЭ выполнить задания:
| 1) Карточки | 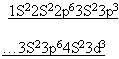 |
Определить период, группу, подгруппу, семейство каждого элемента. Указать число валентных электронов. Составить общую формулу высшего оксида, формулу летучего водородного соединения (если оно существует). Ответ обосновать.
2) Построить электронную формулу элемента с порядковым номером 25 / без ПСХЭ/
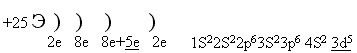
УЧЕНИК. На первом энергетическом уровне максимально может быть 2 электрона, на втором 8 электронов. На третьем уровне 8 электронов, затем заполняется 4s подуровень, лишь после этого подуровень 3d, оставшимися 5е ( по принципу наименьшей энергии).
Mn - определяем по ПСХЭ, после построения электронной формулы /знак элемента выставляем на демонстрационном столе/
III этап. “Теоретический”.
Работа с тестами /Приложение 1/.
Дать комментированный ответ на тестовые задания. Подготовка к ЕГЭ.
IV этап.
Проверка индивидуальных задач, решенных на доске.
По решенным заданиям, определяем элементы Br Cu Mg /знаки элементов выставляем на демонстрационном столе/
V этап. “Игровая пауза”.
Отгадать ребусы.
 |
 |
1) Олово Sn
|
2) Никель Ni
|
VI этап. “Расчетный”.
Решить задачи.
1) Элемент образует высший оксид Э2О5. массовая доля водорода в его водородном соединении 8,82%. Определить элемент, составить формулу гидроксида, указать характер./ Р /
2) Атом элемента имеет на 2 электрона меньше чем ион калия. Определить элемент, составить электронную формулу его атома и иона. / S /
VII этап. “Химический элементарий”
Br, Sn, Ni, P, S, Cu, Mn, Mg /знаки химических элементов, определенных по заданиям/
В природе ничего другого нет
Ни здесь, ни там, в космических глубинах,
Все: от песчинок малых до планет –
Из элементов состоит единых.
Как формула, как график трудовой
Строй Менделеевской системы строгий
Вокруг тебя творится мир живой
Входи в него, вдыхай, руками трогай
Демонстрация образцов простых веществ и соединений этих элементов.
VIII этап. “Исторический”.
УЧИТЕЛЬ. Каким же человеком был Д.И.Менделеев, открывший ПЗ?
УЧЕНИК.
Мир сложен.
Он полон событий, сомнений,
И тайн бесконечных, и смелых догадок.
Как чудо Природы,
Является гений
И в хаосе этом
Находит порядок.
Гением в области химии можно назвать Д.И.Менделеева.
Сообщение ученика по теме “Три службы Родине: наука, промышленность, педагогика”
УЧИТЕЛЬ. Закончить сегодняшний урок мне бы хотелось словами Д.И.Менделеева.
Напутствие молодым.
“Берегитесь больше всего своих же гордых мыслей. Гордитесь только тем, что сделано для других, не кичитесь этим, гордитесь внутри себя, этой гордостью возвышайтесь, она не дает забыться. Удовольствие пролетит, оно – себе, труд оставит след долгой радости – он другим. Учение – себе, плод учения – другим. Сами, трудясь, вы сделаете все для близких и для себя. И если успеха не будет, будет неудача, не беда. Попробуйте еще раз!”
Эти слова особенно актуальны для вас, будущих выпускников, которым предстоит найти свое место в жизни.
IX этап. Подведение итогов урока.
Д/з подготовка к контрольной работе.