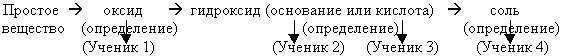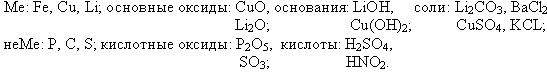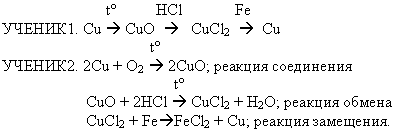Генетическая связь между классами неорганических соединений
Многие вещи нам непонятны не потому, что наши понятия слабы; но потому, что сии вещи не входят в круг наших понятий.
(Козьма Прутков.)
Цели урока:
- Проверить умения распознавать формулы основных классов неорганических веществ
- (оксидов, кислот, оснований, солей), а также классифицировать химические элементы на металлы и неметаллы.
- Продолжить развитие умений строить логические связи, осмысленно двигаясь по генетической цепочке “ простое вещество – оксид – гидроксид – соль”, развивать практические умения и навыки, а также умение делать выводы.
- Продолжить формирование понятия о единстве органических и неорганических веществ, об отсутствии резкой границы между веществами живой и неживой природы.
Тип урока: обобщение знаний и умений, их систематизация.
Методы и методические приемы.
Индивидуальная и групповая работа с карточками химических формул; самостоятельная работа по составлению химических уравнений; работа на обычной и магнитной доске; выполнение лабораторной работы; демонстрационный эксперимент.
Оборудование и реактивы.
Спиртовка, тигельные щипцы, проборкодержатель, подставка для пробирок, пробирка ПХ – 14, медная проволока, гвоздь или скрепка, нитки; колба с пробкой, ложка для сжигания веществ, фосфор (сера), вода, гидроксид натрия, лакмус, раствор соляной кислоты (1:2).
Наборы карточек с формулами веществ разных классов (1 и 2 варианты). Листы чистой бумаги.
Ход урока
I. Организационный момент.
1. Дисциплина.
2. Готовность класса к уроку.
3. Постановка цели урока, мотивация.
II. Основная часть.
УЧИТЕЛЬ. Тема урока: “Генетическая связь между классами неорганических соединений”. На уроке мы с вами рассмотрим небольшие фрагменты взаимопревращений веществ, вспомним классификацию неорганических веществ, поговорим о единстве и многообразии химических веществ.
Материальный мир, в котором мы живем и крохотной частичкой которого мы являемся, един и в то же время бесконечно разнообразен. Все находится в непрерывном движении, в непрерывном химическом превращении. Бесконечно из одних веществ получаются другие[2]. Но иногда эти превращения оказывают негативное влияние на живые организмы, воду, атмосферу, горные породы.
Вы не раз замечали, что листья растений вянут и желтеют (появляются пятна), особенно после дождя. Вы не задумывались, почему это происходит?
УЧЕНИК. Предполагаю, что это влияние кислотных дождей.
УЧИТЕЛЬ. Верно, а знаете ли вы, как они образуются и почему?
УЧЕНИК. Дождь всегда представлял собой слабую кислоту: ведь содержащийся в воздухе углекислый газ реагирует с водой, образуя слабую угольную кислоту.
УЧИТЕЛЬ. Но с развитием промышленности, транспорта кислотность дождя резко повысилась. В поселке Аксарайск построен Газоперерабатывающий завод (ГПЗ), который перерабатывает сероводород:
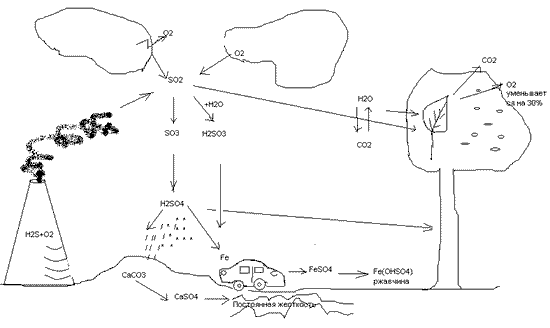
Рисунок 1. Схема образования кислотных дождей в п. Аксарайск
Диоксид серы, попавший в атмосферу, претерпевает ряд химических превращений, ведущих к образованию кислот.
Частично диоксид серы в результате фотохимического окисления превращается в триоксид серы (серный ангидрид) SO3, который реагирует с водяным паром атмосферы, образуя аэрозоли серной кислоты:
2SO2 + О2 —> 2SO3, SO3 + Н2O —> H2SO4.
Основная часть выбрасываемого диоксида серы во влажном воздухе образует кислотный полигидрат SO2 • nH2O, который часто называют сернистой кислотой и изображают условной формулой H2SO3:
SO2 + Н2O —> H2SO3.
Сернистая кислота во влажном воздухе постепенно окисляется до серной:
2Н2SO3 + O2 —> H2SO4.
Аэрозоли серной и сернистой кислот приводят к конденсации водяного пара атмосферы и становятся причиной кислотных осадков (дожди, туманы, снег) [1].
Кислотные дожди действуют на карбонаты, превращаясь в нерастворимые сульфаты, которые в свою очередь дают воде постоянную жесткость. Кислотные дожди действуют на металлы, которые постепенно подвергаются коррозии: 2FeSO4 + Н2O +0,5O2 —> 2 Fe(OHSO4). Слабая угольная кислота снижает выделение кислорода в процессе фотосинтеза на 30%.
(Ученикам раздают схему образования кислотных аэрозолей и дождей (рис. 2).)
Рисунок 2. Механизм образования кислотных осадков[1]. (Приложение)
УЧИТЕЛЬ. Напишите цепочки превращений, которые здесь встречаются .
УЧЕНИК. S —> SO2—> SO3 —> H2SO4 CaSO4
Демонстрационный эксперимент. Учитель показывает в пробирках образцы :
1 – кусочек кальция, 2 – негашеная известь, 3 – гашеная известь, 4 - гипс задает вопрос:
“Что общего между этими образцами?” и записывает цепочку из формул представленных образцов.
УЧИТЕЛЬ. Ca—> CaO —> Ca(OH)2 ![]() CaSO4
CaSO4
УЧИТЕЛЬ. Составьте химические уравнения следующих превращений. Уравнения между электролитами составьте в молекулярной и ионной форме.
УЧЕНИК 1. S + O2—>SO2; SO3 + H2O—> H2SO4 ;
2SO2 + O2—> 2SO3; H2SO4 + CaCO3
—> CaSO4
+ H2O + CO2
УЧЕНИК 2. 2Ca + O2—>2CaO; CaO + H2O —> Ca(OH)2
УЧЕНИК 3. H2SO4 + Ca(OH)2—> CaSO4
![]() + 2H2O
+ 2H2O
2H+ +SO42-- + Ca2++2ОН—>CaSO4+H2O
УЧИТЕЛЬ. Записали в виде формул происходящие явления и получили логические цепочки. Что общего в цепочках превращений?
УЧЕНИК. В этих цепочках повторяется один и тот же элемент (Ме или НеМе) в формулах разных классов веществ, а в результате превращений получается соль CaSO4 .
УЧИТЕЛЬ. Правильно. Такие цепочки называются генетические ряды. Эти ряды образуют “родственные вещества”, которые взаимосвязаны между собой генетическими связями. Т.е.имеют одно начало. Какие вещества в генетическом ряду будут родственны. Назовите классы веществ, дайте определение каждому классу веществ.
УЧЕНИК.
УЧИТЕЛЬ. Хорошо. Теперь распределите карточки с веществами по группам и ответы запишите на листах бумаги.
В это время ученик у магнитной доски распределяет свой комплект карточек: Fe, P, Cu, Li,
C, S, LiOH, H2SO4, Li2CO3, HNO2, BaCl2, Cu(OH)2, CuSO4, CuO, P2O5, KCL, SO3, Li2O.
УЧЕНИК.
УЧИТЕЛЬ. Осуществите взаимопроверку в парах, исправьте ошибки, если они имеются.
А теперь составьте из предложенных на доске веществ генетические ряды:
УЧЕНИК 1. Cu —> CuO —> CuSO4 —> Cu(OH)2
УЧЕНИК 2. Li —> Li2O —> LiOH —> Li2CO3
УЧЕНИК 3. S —> SO3 —> H2SO4 —> CuSO4
(обратить внимание на построенный ряд первым учеником: (если основание нерастворимо, то ряд строится так: Ме —> оксид —> соль —> основание ))
УЧИТЕЛЬ. Хорошо, ребята! Подумайте, можно ли с помощью химических реакций перейти от простых веществ к сложным, от одного класса соединений к другим. Давайте проведем эксперимент, доказывающий присутствие атомов меди в разных её соединениях. По ходу эксперимента запишите цепочку превращений. Назовите типы химических реакций.
Работа выполняется по инструктивной карте. Соблюдайте правила техники безопасности!
Инструктивная карта.
Лабораторная работа: “Практическое осуществление цепочки химических превращений”.
Проверьте наличие оборудования и реактивов на рабочих местах.
Оборудование: штатив для пробирок, пробирка ПХ – 14, спиртовка, спички, зажим для пробирок, тигельные щипцы.
Реактивы и материалы : раствор соляной кислоты (1:2), медная проволока, железный гвоздь или скрепка, нитки.
Выполнение работы.
Проведите реакции, в которых осуществляются химические превращения.
Медная проволока —> оксид меди(II) —> хлорид меди(II) a медь
Прокаливайте медную проволоку, удерживая её тигельными щипцами, в верхней части пламени спиртовки(1-2мин). Что наблюдаете?
Аккуратно удалите черный налет с проволоки и поместите его в пробирку. Отметьте цвет вещества.
Прилейте в пробирку в пробирку 1 мл раствора соляной кислоты (1:2). Для ускорения реакции слегка нагрейте её содержимое. Что наблюдаете?
Осторожно (почему?) погрузите в пробирку с раствором железный гвоздь (скрепку).
Через 2-3 мин извлеките гвоздь из раствора и опишите произошедшие с ним изменения.
Образованием какого вещества они вызваны?
Опишите и сравните цвет образовавшегося и исходного растворов.
Отчет о работе оформите в свободной форме.
Приведите рабочее место в порядок.
ВНИМАНИЕ! Раствор с оксидом меди нагревать очень осторожно, держа пробирку высоко над пламенем спиртовки.
III. Заключение.
УЧИТЕЛЬ. Ребята, пришло время подводить итоги. Чему вы сегодня научились, что узнали нового, что вы делали на уроке?
УЧЕНИК . Мы рассмотрели небольшие фрагменты взаимопревращений веществ. Эти взаимопревращения различных веществ называются генетической связью (от слова “генезис” - происхождение) или (“генео” - рождаю) [2]. Выполняли лабораторную работу.
УЧИТЕЛЬ. Понятия “оксид”, “кислота”, “основание”, “соль” образуют систему, находящуюся в тесной взаимосвязи, она раскрывается при получении веществ одного класса из веществ другого класса. Она проявляется в процессе взаимодействия веществ и активно используется в практической деятельности человека. Как вы думаете, ребята, достигли мы цели, которую ставили в начале урока? Сейчас мы это проверим.
IV.Закрепление знаний.
Назовите признаки, которые характеризуют генетический ряд.
Даны цепочки превращений:
a) Br2 —> HBr —> NaBr —> NaNO3
б) Fe —> FeCl2 —> Fe(OH)2 —> FeO —> Fe
в) CaCO3 —> CaO —> CaC2 —> C2H2
г) Si —> SiO2 —> Na2SiO3 —> H2SiO3
1-й уровень. Найдите и выпишите генетические ряды элементов. Запишите уравнения химических реакций, иллюстрирующих переходы для одного генетического ряда.
2-й уровень. Найдите и выпишите генетические ряды элементов. Запишите уравнения химических реакций, иллюстрирующих переходы для одного генетического ряда. Реакции ионного обмена запишите в молекулярной и ионной форме.
V. Домашнее задание.
УЧИТЕЛЬ. Ребята, запишите домашнее задание:
P + … —>P2O5; P2O5 + H2O —>…; … + NaOH —> … + H2O
Вставьте пропущенные формулы веществ, расставьте коэффициенты. Генетический ряд какого элемента можно составить в данном случае.
VI. Подведение итогов урока, оценивание.
Литература.
- Боровский Е.Э.Кислотные осадки. Парниковый эффект.- М. :Чистые пруды, 2005;
- Габриелян О.С.Настольная книга учителя химии 8 класс.-М.: “Блик плюс”, 2000;
- Кузнецова Н.Е., Титова И.М., Гара Н.Н., Жегин А.Ю. Химия: Учебник для учащихся 9 класса общеобразоват. учрежд.-М.: “Вентана-Граф”, 2003.