Метод учебного проекта становится все более популярным в современной школе. Особенно удачно он вписывается в систему естественно-научного образования, где учащиеся имеют возможность применить полученные в школе теоретические знания по химии, биологии, экологии, на практике, в процессе выполнения социально значимого учебного исследования.
Интегрированный химико-экологический курс “Вода. Жесткость воды” разработан и апробирован на базе факультатива по химии нашей школы.
Методики просты в исполнении.
Исследовательские проекты школьников, выполненные в процессе работы по данному курсу, были представлены на экологических научно-практических конференциях школьников Южного Подмосковья “Экополис – город будущего” в 2005-2007 г.г., Всероссийских фестивалях, в частности, фестивале исследовательских и творческих работ школьников “Портфолио 2005-2006, 2006-2007”, и Международных экологических форумах, таких, как “Зеленая планета” в 2006 г., где были награждены Дипломами участников и Лауреатов.
Нам хочется поделиться накопленным позитивным опытом в использовании такого метода, как учебно-исследовательский проект, мы представляем разработку одного из факультативных занятий и мультимедийную презентацию к нему.
Занятие было показано на городском Фестивале увлекательной науки, техники и культуры 3-4 января 2008г. Занятие освещалось в эфире Пущинского телевидения и в газете “Пущинская среда”.
Тема занятия: Определение общей жесткости водопроводной водыи исследование эффективности методов снижения общей жесткости.
Цель занятия: Определить общую жесткости водопроводной воды и исследовать эффективность методов снижения общей жесткости.
Задачи:
Экспериментальные
- Ознакомиться по литературным источникам с характеристикой качества питьевой воды “Общая жёсткость”;
- Определить экспериментально общую жесткость водопроводной, профильтрованной, вымороженной, прокипяченной воды. По соответствующим таблицам жесткости воды определить, к какому типу относятся исследуемые образцы;
Учебные
- По соответствующим нормативам ГОСТ определить физиологическую безопасность исследуемых образцов воды (соответствие оптимальному физиологическому уровню, ПДК – предельно допустимым концентрациям, директивным уровням ПДК);
- Сделать вывод о необходимости снижения содержания гидрокарбонатов кальция и магния в питьевой воде;
- Выяснить причину высокого содержания гидрокарбонатов кальция и магния в воде.
- Определить экспериментально общую жесткость воды после фильтрования бытовым фильтром, кипячения, вымораживания.
- Сделать вывод об эффективности снижения содержания гидрокарбонатов кальция и магния в воде различными методами.
- Сделать вывод об оптимальном методе снижения общей жесткости.
- Развитие аналитического мышления в ходе планирования и осуществления эксперимента.
Воспитательные
- Обучение умению работы в группах для достижения общей цели
- Формирование ситуации успеха и взаимопомощи у учащихся.
ХОД ЗАНЯТИЯ
1. Оргмомент, цели, задачи.
2. Теоретическая часть. Вода. Значение в жизни человека, показатели качества пресной воды, общая жесткость воды, ГОСТ. Мультимедиа презентация.
3. Экспериментальная часть. Правила ТБ. Работа в группах. Определение общей жесткости воды в образцах “Водопроводная вода”, “Вода после фильтрования”, “Вода после вымораживания”, “Вода после кипячения”.
4. Оформление результатов эксперимента: познакомиться с протоколом занятия, пояснить ход эксперимента, химическую сущность процесса. Оформление протоколов экспериментов. Определить степень снижения общей жесткости воды после кипячения, вымораживания и фильтрования. Составить диаграмму по полученным результатам, с помощью цветной бумаги на ватмане со шкалой “%” отобразить результаты экспериментов.
5. Выводы. Сделать выводы и записать их в протокол. Сделать рекомендации и записать их в протокол.
6. Итоги занятия
7. Оценка занятия
ИНСТРУКЦИЯ ПО ОПРЕДЕЛЕНИЮ ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ
РЕАКТИВЫ ДЛЯ ОПРЕДЕЛЕНИЯ ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ
- Раствор ЭДТА (Трилон – Б) 0,1 н
- Аммиачный буфер: 2% по NH4Cl и 2% по NH3
- Индикатор эриохром черный – Т 0,5%
МЕТОДИКА ОПРЕДЕЛЕНИЯ ОБЩЕЙ ЖЕСТКОСТИ ВОДЫ
В 100 мл воды добавить 5 мл аммиачного буфера, 3-4 капли раствора индикатора, перемешать. Титровать раствором ЭДТА при перемешивании до изменения цвета индикатора.
ВЫЧИСЛЕНИЕ РЕЗУЛЬТАТОВ
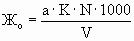 ,
,
где Жо – общая жесткость воды в мг-экв/л;
а – расход ЭДТА в мл;
К – коэффициент нормальности раствора ЭДТА;
N – номинальная нормальность раствора ЭДТА;
V – объем пробы воды в мл.
Если для анализа взято 100 мл воды и К = 1, то при нормальности раствора ЭДТА 0,1 , V ЭДТА = Жо.
ХИМИЧЕСКАЯ СУЩНОСТЬ
В щелочной среде (которая создаётся смесью аммиака и хлорида аммония) ЭДТА образует с кальцием и магнием прочное комплексное соединение, причём, поскольку соединение с кальцием прочнее, он связывается в первую очередь. Эриохром чёрный – Т образует с магнием розовое комплексное соединение. Когда весь магний связывается с ЭДТА, высвобождается свободный индикатор синего цвета.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
ЭКСПЕРИМЕТНАЛЬНОЕ
- Образец тестируемой воды
- Колба 150мл
- Стеклянная палочка
- Цилиндр 100мл
- Пробирка с аммиачным буфером
- Шприц для титрования с раствором ЭДТА
- Штатив для пробирок
- Флакон с красителем
ВСПОМОГАТЕЛЬНОЕ
- Оборудование для мультимедийной презентации
- Ватман
- Цветная бумага
- Набор канцелярских принадлежностей
ХОД ЭКСПЕРИМЕНТА
- ПОВТОРИТЬ ПРАВИЛА ТБ.
- Отмерить 100 мл исследуемой воды мерным цилиндром;
- Перенести воду в колбу
- Добавить 5 мл буфера из пробирки
- Перемешать стеклянной палочкой
- Добавить индикатор до розового окрашивания раствора
- Оттитровать раствором ЭДТА из шприца до синего окрашивания. Впрыскивать понемногу!
- Отметить объем ЭДТА, затраченный на титрование
- Записать результат в протокол.
- Сделать столбики для диаграмм, приняв общую жесткость водопроводной воды за 100 %, рассчитав % снижения жесткости каждым методом очистки. Прикрепить столбики на ватман.
- Написать выводы.
- Подписать протокол.
ПРОТОКОЛ ОПЫТА
| № п/п | Задание | Результат |
| 1 | Определить общую жесткость (водопроводной, профильтрованной, вымороженной, прокипяченной ) воды | |
| 2 | Рассчитать снижение общей жесткости после фильтрования, кипячения или вымораживания. | |
| 3 | Проиллюстрировать результаты графически: на листе ватмана с помощью столбиков из цветной бумаги | |
| 4. | Сделать выводы. Какова жесткость водопроводной воды в Пущино? К какой категории жесткости относится эта вода? Соответствует ли оптимальной физиологической норме? Превышает ли жесткость водопроводной воды в г. Пущино ПДК и директивную ПДК? Какова жесткость воды после кипячения, фильтрования и вымораживания? Снижают ли использованные приемы жесткость воды? На сколько процентов снижается жесткость воды при кипячении, фильтровании и вымораживании? Какой из исследованных методов наиболее эффективно снижает жесткость? Какой из способов снижения общей жесткости воды наиболее физиологичен? Каковы Ваши рекомендации по снижению жесткости используемой дома воды? |
Дата: Подпись:
ОЦЕНКА ЗАНЯТИЯ
Для того, чтобы повысить эффективность проведения подобных научно-познавательных мероприятий, просим Вас оценить наше занятие по следующим пунктам:
Поставьте “+” в соответствующей графе
| № п/п | Критерий оценки | ДА | НЕТ |
| 1 | Тема занятия актуальна для жителей нашего города | ||
| 2 | Методики, используемые на занятии легки и доступны | ||
| 3 | Получена новая информация | ||
| 4 | Было интересно | ||
| 5 | При скоординированной работе в группе цель достигается быстрее |
ЛИТЕРАТУРА
- ГОСТ 2874 – 82 “Питьевая вода”.
- Жилин Д.М. Школьная экспедиционная лаборатория для анализа природных вод. Руководство пользователя. Материалы Всероссийской научно – практической конференции “Человек на Земле”. Пущино, 2003.
- Кручилина М.Е., Александрова М.М., Кручилина Е.Ю. Химический анализ качества водных сред в центрах школьного экологического мониторинга. М. Некоммерческое партнерство “Содействие химическому и экологическому образованию”, 2003.
- Хомченко Г.П. Химия для поступающих в ВУЗы. М. “Высшая школа”. 1995.
- Шретер В. Химия. Справочник. М. “Химия”. 1989.