Образовательные задачи:
Главная: изучить состав, строение, свойства фенола и его соединений
Сопутствующие:
- на примере фенола конкретизировать знания учащихся об особенностях строения веществ, принадлежащих к классу фенолы, рассмотреть зависимость взаимного влияния атомов в молекуле фенола на его свойства
- познакомить учащихся с физическими и химическими свойствами фенола и некоторых его соединений, изучить качественные реакции на фенолы
- рассмотреть нахождение в природе, применение фенола и его соединений, их биологическую роль
Развивающие задачи:
- совершенствовать умение учащихся прогнозировать свойства вещества на основе его строения
- продолжать развивать умение наблюдать, анализировать, делать выводы при выполнении химического эксперимента
Воспитательные задачи:
- продолжить формирование химической картины мира через химическую картину природы (познаваемость, управление химическими процессами)
- расширить представление учащихся о влиянии фенолсодержащих промышленных отходов и строительных материалов на окружающую среду и здоровье человека
- рассмотреть биологическую роль фенола и его соединений на организм человека (положительную и отрицательную)
Тип урока:
урок - изучения новых знаний.
Методы обучения:
словесный, наглядный, практический (химический эксперимент – ученический и демонстрационный)
Средства обучения:
ТСО (графопроектор и кодосхемы), школьный химический эксперимент (демонстрационный и ученический), опорные конспекты, тестовые задания по материалам ЕГЭ (уровень А для работы на уроке, уровни В и С для выполнения дома)
Оборудование и реактивы:
Демонстрационный эксперимент: растворы С6Н5ОН, NaOH, FeCl3, бромная вода, HNO3(конц), Na, пробирки, резиновые пробки
Лабораторный опыт на определение наличия фенольных соединений в чае: пробирки с раствором чая, раствор FeCl3
План урока
1.Организационный момент
2.Актуализация знаний
3.Изучение новых знаний
? Какие спирты называются ароматическими
Работа по кодосхеме 1

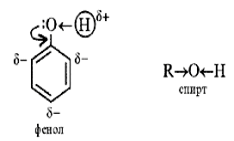
? Будут ли отличаться химические свойства у соединений, в одном из которых группа -ОН связана непосредственно с бензольным ядром, а в другом через атом углерода !!! Верно, согласно одного из положений теории Бутлерова, которое гласит, что свойства органических соединений зависят не только от состава вещества и порядка соединения атомов в молекуле, но и от взаимного влияния атомов и групп атомов друг на друга. Причем, наибольшее влияние оказывают атомы непосредственно связанные друг с другом. Влияние атомов или групп атомов, не связанных непосредственно ослабевает по мере их удаления друг от друга.
- Определение фенолов Соединения, в которых ароматический радикал фенил С6Н5- непосредственно связан с гидроксильной группой, отличаются по свойствам от ароматических спиртов, настолько, что их выделяют в отдельный класс органических соединений, называемый фенолами.
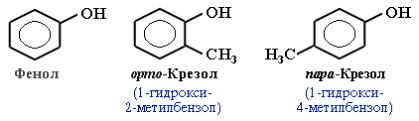
- классификация и изомерия фенолов В зависимости от числа ОН-групп различают одноатомные фенолы (например, вышеприведенные фенол и крезолы) и многоатомные. Среди многоатомных фенолов наиболее распространены двухатомные:
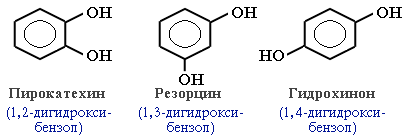
Как видно из приведенных примеров, фенолам
свойственна структурная изомерия (изомерия
положения гидроксигруппы).
Следствием
полярности связи О–Н и наличия неподеленных пар
электронов на атоме кислорода является
способность гидроксисоединений к образованию водородных
связей
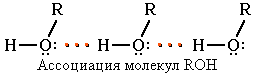
Это объясняет, почему у фенола довольно высокие температуры плавления (+43) и кипения (+182). Образование водородных связей с молекулами воды способствует растворимости гидроксисоединений в воде:
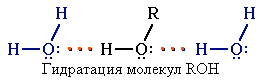
Способность растворяться в воде уменьшается с увеличением углеводородного радикала и от многоатомных гидроксисоединений к одноатомным. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Растворимость фенола в воде ограничена.
- Строение молекулы фенола
 Кодосхема 2 |
|
- Химические свойства фенола (проводится демонстрационный эксперимент)
а) Рассмотрим реакции фенола по ОН-группе:
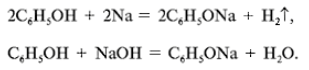
Кислотные свойства у фенола выражены сильнее, чем у спирта С2Н5ОН. Фенол – слабая кислота (карболовая).
б) Реакции фенола по бензольному кольцу:
![]()
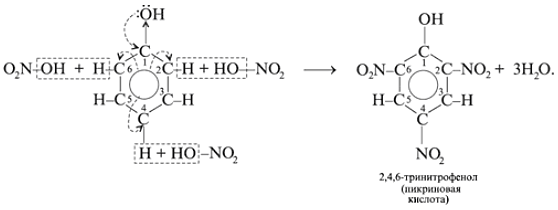
Какой вывод о взаимном влиянии атомов в
молекуле фенола можно сделать?
Фенильная группа C6H5 – и гидроксил
–ОН взаимно влияют друг на друга. (кодосхема 3 )

в) Качественная реакция на фенолы
С6Н5ОН + FeCl3 —> фиолетовое
окрашивание С6Н5ОН + Br2 —>
белый осадок С6Н4(ОН)2 + FeCl3
—> зеленое окрашивание,
С6Н3(ОН)3 + FeCl3 —> красное
окрашивание,
Проводится ученический эксперимент по определению наличия фенолов в чае
- Получение фенола самостоятельно (по опорному конспекту)
- Физиологическое действие фенола и его применение
Фенол - ядовит!!! При попадании на кожу вызывает ожоги, при этом он всасывается через кожу и вызывает отравление.
Биологическая роль соединений фенола (кодосхема)
Положительная |
Отрицательная (токсическое действие) |
|
|
- Первичное закрепление знаний ПОДУМАЙ и ОТВЕТЬ (задания части А ЕГЭ)
- Рефлексия