Дидактические игры, умело применяемые педагогом на уроках, позволяют развивать творческие способности учащихся, так как побуждают поисковую активность, разрушают психологическую инертность, апатию. Особое значение игра приобретает в работе с детьми, у которых преобладает работа правого полушария. Таких детей легко выделить - они пишут левой рукой.
Кроме того, существуют простые приёмы для определения преобладающей активности какого-либо полушария:
- Прицельтесь на воображаемый отдалённый объект (обратите внимание, какой глаз закрывает ребёнок, и какой рукой целится);
- Положите руку на руку (ногу на ногу). Какая рука сверху?
- Похлопайте в ладоши. Какая рука сверху?
Согласно ассиметрии правополушарные дети работают больше левой рукой (ногой), а левополушарные - наоборот.
Использование игр на уроках - необходимое условие развития учащихся. Конечно, наряду с решением иллюстрированных задач и созданием положительной эмоциональной окраски учебной деятельности, любые обучающие игры должны иметь большую содержательную и познавательную насыщенность, научность.
Можно выделить ролевые игры (КВН, уроки-суды, викторины) и игры-тренажеры (логические цепи, игры на нахождение сходства и различия, восстановления пропущенного, на продолжения ряда, или удаление лишнего, загадки и др.).
Игры-тренажеры, конечно более просты в реализации, чем ролевые игры со сценарием и требуют не так много времени на подготовку, репетиции и проведение. Любая игра направлена на развитие интеллектуальной, эмоциональной сфер личности обучающегося.
Приведу несколько примеров дидактических игр, которые можно использовать на уроках химии.
I. Логические цепи.
Учитель задаёт начало фразы: "Калий - металл". Первый ученик повторяет его и придумывает продолжение со словами "потому что", "следовательно", "поэтому". Затем всё сказанное повторяет и продолжает следующий ученик. Тот, кто не смог продолжить цепочку, выбывает из игры. Далее учитель предлагает новую фразу.
II. Сходства и различия.
Игра тренирует умение давать сравнительную характеристику. Учитель предлагает учащимся два химических объекта: два вещества, два элемента, физическое и химическое явления, два химических явления, смесь и соединение и т.д. Учащиеся должны найти и выписать в две колонки как можно больше общих признаков и отличий этих объектов. Затем школьники объединяются в пары или четвёрки и составляют общий список. Вслух зачитывают самый длинный перечень, его дополняют признаками, которые не были отмечены, из списков других групп. Дальнейшая работа со списком может быть различной. Можно предложить учащимся выделить наиболее существенные признаки и аргументировать свой выбор либо выбрать признаки, которые помогут: а) различить объекты; б) разделить объекты; в) классифицировать объекты.
III. Восстанови пропущенное.
В клетках игрового поля записаны знаки химических элементов, некоторые из них отсутствуют. Известно, что:
- по периметру квадрата находятся символы элементов только главных подгрупп и только металлов;
- в верхнем и нижнем рядах закономерно изменяется число электронов на внешнем энергетическом уровне атомов элементов;
- в среднем ряду - знаки элементов II группы;
- по диагонали слева направо записаны знаки элементов, образующих амфотерные оксиды и гидроксиды.
Восстановите пропущенные символы, ответ мотивируйте.
| Al | ? | Na |
| ? | Zn | Ca |
| K | Sr | ? |
Вариант ответа:
| Al | Mg | Na |
| Ba | Zn | Ca |
| K | Sr | Ga |
IV. Продолжи ряд.
Заданы несколько членов ряда. Нужно обнаружить закономерность чередования объектов и продолжить ряд:
а) Li, Al, As, :;
б) F,- :, Na+, S2-, Ar, :
Варианты ответов:
а) Li, Al, As, Ts;
б) F,- Ne, Na+, S2-, Ar, Ca2+, As3-, Kr, In3+.
V.Убери "лишнее".
В предложенных ниже рядах присутствуют "лишние" формулы. Найдите их:
а) NaCl; AgNО3; KCl; KNО3;
б) H2S; CaSO4; HI; (NH4)2S.
Варианты ответов: а) KNO3 или AgNO3; б) CaSO4.[1]
Можно придумать множество таких игр-тренажеров, вот, например, другой вариант:
а) CaO, CuO, SO2 ;
б) HNO3, H2S, H2O;
в) Na2SO4, H2SO4, BaCl2;
г) NaOH, Al(OH)3, Al(NO3)3.
В каждой строчке вычеркнуть формулу вещества, принадлежащего не тому классу, к которому относятся два других. Объясните, почему?
VI. Игровые карточки-задания "Заполни поле"
Заполните нижнее игровое поле значениями относительных молекулярных масс соответствующих веществ.
| NaOH | (CuOH)2CO3 | H2SO4 |
| KNO2 | Na2CO3 | MgCl2 |
| KMnO4 | H3BO3 | Ca(OH)2 |
Игровые карточки-задания по теме "Основные класс неорганических соединений"
Заполните нижнее игровое поле названиями соответствующих веществ.
| NaOH | (CuOH)2CO3 | H2SO4 |
| KNO2 | Na2CO3 | MgCl2 |
| KMnO4 | H3BO3 | Ca(OH)2 |
Игровые карточки-задания по теме "Водород"
Заполните нижнее игровое поле формулами продуктов реакций.
| H2+O2> | H2+Cl2> | H2+F2> |
| H2+Ca> | H2+N2> | H2+S> |
| H2+Na> | H2+Fe2O3> | H2+BCl3> |
VII. "Крестики-нолики"
Вычеркни правильный ряд солей.
По какому признаку можно классифицировать соли?
а)
| NaCl | Li2SO4 | Pb(NO3)2 |
| NaHS | CaCO3 | Na2 SiO3 |
| Na3PO4 | Cu(OH)Cl | Zn(OH)NO3 |
б)
| NaCl | Li2SO4 | Pb(NO3)2 |
| NaHS | CaCO3 | Na2 SiO3 |
| Na3PO4 | Cu(OH)Cl | Zn(OH)NO3 |
Варианты ответов: а) Na3PO4, CaCO3, Pb(NO3)2; б) NaCl, Li2SO4, Pb(NO3)2.
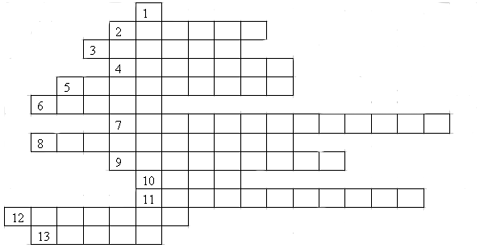
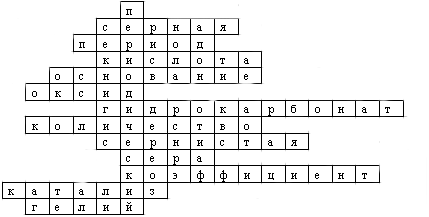
VIII. Кроссворд
Заполните поля ответами на следующие вопросы:
- Один из основополагающих законов химии;
- Серосодержащая кислота;
- Горизонтальный ряд таблицы Д.И. Менделеева;
- Сложное вещество, с состав которого входит один или несколько атомов водорода и кислотный остаток;
- Сложное вещество, содержащее одну или несколько гидроксильных групп;
- Сложное вещество, состоящее из двух видов атомов, одним из которых является кислород;
- название кислотного остатка НСО3-;
- :вещества;
- название кислоты Н2SO3;
- название элемента, обозначающегося символом S;
- в записи " 5 Н2О" цифра "5";
- Процесс ускорения реакции в присутствии других химических веществ, при этом нерасходующихся;
- название химического элемента Не.
Ответы на кроссворд:
IX. Загадки на тему "Периодическая система химических элементов Д.И. Менделеева"
Учитель предлагает учащимся, угадать о каком химическом элементе идет речь:
Варианты вопросов:
А)
- Элемент, который светится, открыт отставным солдатом, гамбургским купцом Брандом;
- Элемент, название которого от греческого - зловонный, открыт Баларом и Левингом в 1826 г.;
- Элемент, название которого от греческого - рождающий воду, открыт Кавендишем в 1776 г.;
- Элемент, название которого от греческого - Франция, его существование предсказал Менделеев на основании открытого им периодического законы в 1871г.;
- Элемент, название которого от греческого - "Германия";
- Элемент, название которого от латинского - "утренняя заря, аура", был известен еще древним цивилизациям;
- Элемент, название которого от греческого - "фиолетовый";
- Элемент, название которого от латинского - "жидкое серебро", названа в честь планеты Меркурий;
- Элемент, назван в честь немецкого физика-теоритика А. Энштейна обнаружен среди осколков деления при термоядерном взрыве (1952 г.) в Тихом океане.
Б)
- за 350 лет до н. э. Аристотель в своих трудах упоминает об этом металле. Алхимики часто называли этот металл меркурием. Этот металл хорошо растворят другие металлы, образуя амальгамы. Пары металла ядовиты. Находится внутри градусника. (Ртуть)
- Весьма распространенный неметалл. Входит в состав белков. Незаменимый элемент в производстве резины. Используется в сельском хозяйстве для борьбы с вредителями виноградной лозы. Горит сине-голубым пламенем. (Сера)[2]
В)
- Тот элемент в печной трубе находим в виде сажи, и в простом карандаше его встречаем даже. (Углерод)
- Горит лиловым в кислороде, свободным нет его в природе. Но соль находит применение как для растений удобренье. (Калий)
Литература:
- Павлова Н.С., Обучающие игры на уроках химии//Химия в школе.- 2001.-№6
- Торгашев В.Н., Школа детективов, для тех, кто любит химию//Химия в школе.- 2001.-№6