Тип урока: комбинированный урок.
Тема урока: « Тепловой эффект химической реакции. Термохимические уравнения».
Цель урока: дать понятие учащимся о термохимических уравнениях, познакомить с решением задач на нахождение теплового эффекта химической реакции.
Задачи урока:
Образовательные: сформировать знания учащихся о термохимических уравнениях, тепловом эффекте химической реакции, экзотермической реакции, эндотермической реакции; научить решать задачи по термохимическим уравнениям; повторить химические свойства кислорода, закрепить навыки составления уравнений химических реакций; закрепить понятия: оксид, бинарное соединение, реакция горения, совершенствовать умения решать задачи по химической формуле ( нахождение массовой доли элемента в веществе ); работать с таблицей Д.И. Менделеева;
Развивающие: развивать внимание, память, логическое мышление, наблюдательность; продолжать формирование умения делать выводы из проведённых наблюдений, сравнивать, совершенствовать умение высказывать и обосновывать суждение.
Воспитательные: воспитывать интерес к предмету химии, коллективизм, чувство здорового соперничества.
Методы ведения урока:
словесные (беседа, объяснение, рассказ)
наглядные (таблица химических элементов Д.И. Менделеева, ТСО, раздаточный материал, шаблоны, плакаты по технике безопасности, кроссворд
практические (демонстрация опытов)
Оборудование урока: таблица Д.И.Менделеева, плакаты по технике безопасности, ТСО, видеофильм «Химия 8» Суровцева Р.П., Гузей Л.С., раздаточный материал, шаблоны, кроссворд, доска.
Реактивы: 2 лаб. стакана, термометр, соль ( нитрат аммония ), концентрированная серная кислота, вода,
Оформление доски:
Тема урока
Схема
Новые слова
Кроссворд
Домашняя работа
Ход урока
1) Организационный момент: сообщение темы урока, целей и задач урока
2) Проверка домашней работы:
А. Фронтальный опрос
Вопросы:
- Какую тему мы начали изучать на предыдущих уроках? (Кислород)
- Назовите химическую формулу кислорода. (О2)
- С какими веществами взаимодействует кислород? (С простыми и сложными)
- Какие продукты получаются в результате реакций с кислородом? (Оксиды)
- Что такое оксиды? Это сложные вещества, состоящие из двух элементов, один
из которых кислород)
- Что такое бинарное соединение? (Соединение, состоящее из двух элементов)
Б. Индивидуальная работа
3 ученика выполняют домашнее задание на доске
Задача № 1. ( ученик со слабой мотивацией )
Вычислите содержание элементов в оксиде серы (VI).
Задача № 2. ( ученик со средней мотивацией )
Определите, какое из соединений железа - FeO или ![]() богаче кислородом?
богаче кислородом?
Задача № 3. ( ученик с сильной мотивацией )
Известно, что в организме человека содержится по массе 65% кислорода. Вычислите, сколько кислорода содержится в вашем организме?
Каждому из трёх учащихся задаются дополнительные теоретические вопросы по определениям, изучаемым ранее.
В. Проверка задания на доске, выставление оценок
Итог домашней работы
- Дайте названия веществам, которые встретились вам в домашней работе ( Оксид серы (VI), оксид железа ( II ), оксид железа ( III ).
- Что общего у этих веществ? ( Это сложные вещества, оксиды ).
- Как можно получить оксиды? ( Устно ).
3) Повторение темы « Кислород. Оксиды. Горение »
Письменное задание на доске ( ученик со средней мотивацией )
Составьте уравнения реакций получения следующих оксидов: оксида углерода (IV), оксида фосфора ( V) , оксида кальция, оксида алюминия, проставьте валентности элементов в полученных веществах.
![]()
Итог повторения, выставление оценки
- Как называются реакции взаимодействия веществ с кислородом? ( Горение, окисление ).
- Какую химическую реакцию человек начал использовать с давних времён7 ( Горение ).
Просмотр отрывка видеофильма ( исторический факт добывания огня ).
- Для чего человеку нужен был огонь? ( Греться, готовить пищу ).
А сейчас мы узнаем, что теплота есть в любой химической реакции.
Запись в тетради новой темы урока.
4) А. Объяснение нового материала ( запись в тетради )
Любая химическая реакция протекает или с выделением, или с поглощением теплоты, т.е. сопровождается тепловым эффектом. Тепловой эффект реакции обозначается Q . Уравнения реакций с указанием теплового эффекта называются термохимическими.
Реакции, протекающие с выделением теплоты, называются экзотермическими.
«Экзо» - наружу например:
![]()
Демонстрационный опыт: вода + концентрированная серная кислота
Повышение температуры воды измеряем до и после реакции.
Техника безопасности при работе с серной кислотой, растворами, со стеклянной посудой, термометром.
Реакции, протекающие с поглощением теплоты, называются эндотермическими.
«Эндо» - внутрь например:
![]()
Демонстрационный опыт: вода + соль ( нитрат аммония )
Понижение температуры воды измеряем термометром до и после добавления соли.
Техника безопасности при работе с сыпучими веществами.
Б. Решение задачи на нахождение теплового эффекта реакции (объяснение учителя )
Количество теплоты, выделившееся или поглотившееся в результате реакции можно измерить калориметром или рассчитать при помощи задачи. Например:
Задача. Какое количество теплоты выделится при сгорании 500 г угля, если тепловой эффект реакции 394 кДж?
В. Закрепление. Самостоятельная работа. ( Учащихся по вариантам выполняют решение задач по карточкам )
Вариант № 1 Вычислите количество теплоты, которое выделится при горении серы массой 32 г, если тепловой эффект реакции 310 кДж.
Вариант № 2 Вычислите количество теплоты, которое выделится при горении водорода массой 100 г, если тепловой эффект реакции 484 кДж.
При выполнении работы осуществляется индивидуальная помощь учителя.
Первые 3 работы оцениваются.
Устная проверка ( 2 ученика комментируют решение )
4) Итог урока, выставление оценок
Что нового вы узнали сегодня на уроке?
5) Закрепление
Учащимся раздаются шаблоны, где вместо пропущенных слов они должны вписать нужные слова.

7) Домашнее задание ( по учебнику ).
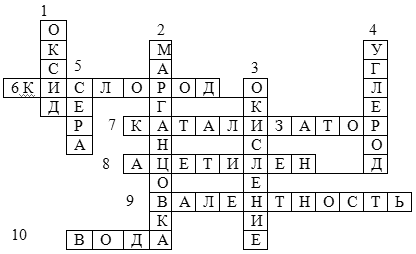
8) Игровой материал ( в оставшееся время учащиеся разгадывают кроссворд по теме: «Кислород».
Кроссворд ( работа с классом )
Вопросы:
1. Сложное вещество, состоящее из двух элементов, один из которых кислород
2. Вещество, при разложении которого в лаборатории получают кислород ( бытовое название )
3. Реакция кислорода с другими веществами
4. Химический элемент, образующий газообразный оксид
5. Вещество жёлтого цвета, горящее в кислороде синим пламенем
6. Самый распространённый на Земле элемент
7. Вещество, увеличивающее скорость химической реакции
8. Вещество, применяющееся с кислородом для сварки и резки металлов
9. Свойство атомов химических элементов присоединять определённое число атомов других химических элементов
10. Оксид водорода