Тип урока:
- по основной дидактической цели: изучение нового материала.
- по способу проведения и этапам учебного процесса: комбинированный.
- по форме проведения: урок – путешествие.
Цели урока:
- образовательные: познакомить учащихся с новыми соединениями химических элементов, принадлежащих классу кислоты
- развивающие: расширение кругозора и развитие интереса к предмету через информационно – коммуникативные технологии
- общеучебные:
а) учебно-организационные: составлять схемы, таблицы.
б) учебно-интеллектуальные: умения сравнивать, анализировать.
в) учебно-информационные: пользоваться компьютером. - воспитательная: воспитание ответственности, бережливости, аккуратности.
Методы обучения:
- по характеру познавательной деятельности: объяснительно-иллюстративный, исследовательский, проблемно – поисковые: проекты учащихся, лабораторная работа
- по виду источника знаний: словесно-наглядные
- по форме совместной деятельности учителя и учащихся: рассказ, беседа
Средства обучения: таблицы, компьютерная сеть, медиа- проектор, презентация по теме «Кислоты», мультимедиа «Уроки химии»
Контроль результатов обучения:
- по способу организации: индивидуальный
- по способу подачи информации: компьютерный контроль
Ход урока:
1. Актуализация знаний.
Учитель: На предыдущих уроках вы познакомились с бинарными соединениями, среди которых HCl, H2S. Как вы считаете, эти соединения относятся к изученным ранее классам?
Учащиеся: Исходя из определения, нет.
Учитель: А к какому классу можем мы отнести эти соединения?
Учащиеся: Не известно.
Учитель: Чтобы разрешить это затруднение или проблему, давайте совершим путешествие в царство Кислот. Запишите в тетради тему урока «Кислоты».
2. Изучение нового материала.
Станция Определений
Учитель: Кислотами называют сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков.
Общая формула кислот такова: Н к.о. [1]
Давайте посмотрим, относятся ли неизвестные нам соединения к классу кислот?
Учащиеся: Исходя из определения, да это кислоты.
Станция Номенклатурная
Учитель: Давайте запишем примеры наиболее часто используемых на уроках химии кислот.
Формулы кислот
HF - фтороводородная, HCl - хлороводородная, HBr – бромоводородная,
HI - иодоводородная, HNO2 - азотистая, HNO3 - азотная
H2S - сероводородная, H2SO3 - сернистая, H2SO4 - серная,
H2CO3 - угольная, H2SiO3 - кремниевая, H3PO4 - ортофосфорная
Как вы считаете, от чего зависят названия кислот? [1] [2]
Учащиеся: Названия зависят от того, какие элементы входят в состав кислоты.
Станция Классификационная
Учитель: Простейшая классификация кислот делит их на бескислородные и кислородсодержащие. Исходя из формул, известных вам кислот, в тетради составьте схему их классификации с примерами.
Учащиеся: Схема классификации кислот.
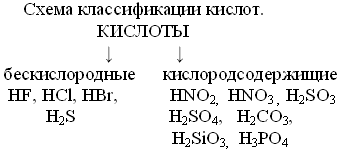
Учитель: Для того, чтобы правильно составить формулу кислоты нужно знать валентность кислотных остатков. Какова валентность к.о., таков и индекс у атома водорода. Поставьте в формулах кислот валентность к.о.[1][2]
Станция Историческая
Учитель: Сейчас мы познакомимся с интересным проектом, который расскажет о происхождении и открытии первых кислот.
Проект № 1 «Происхождение и открытие кислот »
Считается, что самой первой известной кислотой была уксусная. О ней упоминается в древнейших рукописях. Само слово «кислота» произошло от латинского названия уксуса ацетум. Почему именно она объясняется очень просто. С древнейших времён люди разводили виноград и запасали впрок виноградный сок. При хранении в сосудах сок бродил, получалось вино. Иногда вино скисало и превращалось в уксус.
Серную кислоту человек знает около 1000 лет. В России она известна под названием «купоросное масло», потому что получали из веществ называемых купоросом. Соляная или хлороводородная кислота и азотная известны с 14 века.
Соляную кислоту называли соляным спиртом, а азотную – селитряной водкой. Сейчас эти названия кажутся странными и смешными, но для тех времён они были удобными. Сразу видно, что соляную кислоту получают из поваренной соли, а азотную – из селитры.
Сжигая фосфор и растворяя образовавшийся белый продукт в воде, англий-ский химик Роберт Бойль получил фосфорную кислоту.
Следующую кислоту – угольную впервые получил в конце 18 века английский химик Джозеф Пристли. Для этого он растворял в воде углекис-лый газ. [3]
Станция Исследовательская
Проект № 2 « Обнаружение кислот с помощью индикаторов»
Распознавать кислоты древние алхимики научились случайно. Однажды Роберт Бойль, изучая свойства соляной кислоты, случайно пролил её. Она попала на сине- фиолетовые лепестки фиалок. Спустя некоторое время лепестки стали ярко – красными. Это явление удивило ученого, и он провёл серию опытов с разными кислотами и цветами разных растений. Оказалось, что васильки, розы и некоторые другие цветы окрашивались в красный цвет.
Так были открыты индикаторы или в переводе с латинского «указатели» кислот. [3]
Учитель: Давайте и мы проведём своё исследование, результаты которого запишем в тетради.
Лабораторный опыт
«Действие кислот на индикаторы»
Цель: изучить действие кислот на индикаторы.
Ход опыта.
Аккуратно налейте в 3 пробирки по 0,5 или 1 мл кислоты и добавьте по нескольку капель индикатора. Для исследования возьмите следующие индикаторы: лакмус, метиловый оранжевый, фенолфталеин. Результаты оформите в виде таблицы.
| Название индикатора | Окраска индикатора в кислой среде |
| Лакмус | Красная |
| Метиловый оранжевый | Красно- розовая |
| Фенолфталеин | Бесцветная |
Исходя из цели опыта, сделайте вывод.
Станция Познавательная
Учитель: Следующий проект погрузит нас в мир интересного и увлекатель-ного.
Проект № 3 «Это интересно»
В природе встречается много кислот: в лимонах – лимонная, в яблоках –яблочная, в листьях щавеля – щавелевая и другие. Эти названия дал им после исследования настоев, полученных из корней и листьев шведский химик Карл Шееле. Муравьи защищаются от врагов, разбрызгивая капельки едкой муравьиной кислоты. Она же содержится в пчелином яде и в жгучих волосках крапивы. При скисании молока образуется молочная кислота. Она же получается и при квашении капусты и силосовании кормов для скота.
Считается, что название кислот произошло оттого, что все они кислые на вкус. Но в наше время среди кислот обнаружены вещества не только кислые, но и горькие (пикриновая кислота), и сладкие (салициловая), и безвкусные (стеариновая). [3]
Станция Правил Техники Безопасности
Учитель: Чаще всего кислоты для работы нужны не концентрированные, а разбавленные. При смешивании с водой серной кислоты выделяется большое количество теплоты. Если воду вливать в серную кислоту, то вода, не успев смешаться с кислотой, может быстро закипеть и выбросить брызги на лицо, руки, одежду. А это очень опасно, потому что концентрированные кислоты обугливают кожу, ткани, и даже древесину. Образуются долго незаживающие язвы, а в тяжелых случаях уродства и потеря зрения. [2]
Чтобы этого не случилось, нужно запомнить простое правило:
Сначала вода, потом кислота, иначе случится большая беда.
Станция Степеней Окисления
Учитель: зная правила расстановки степеней окисления, поставьте их в формулах кислот, написанных на доске.
HBr, HNO2, HNO3 , H2SO3, H2S, H2SO4
Аналогичное задание нужно выполнить в упражнении № 3 после параграфа 20.
Станция Диагностическая
ВУВ на «5»
- Из перечисленных соединений выписать формулы:
а) оксидов
б) оснований
в) кислот.
Дать веществам названия.
HCl, Fe2O3, KOH, H3PO4 , Mg(OH)2, NO2, Fe(OH)3, F2O7, H2SiO3
- Расставить степени окисления элементов во всех веществах.
СУВ на «4»
- Из перечисленных соединений выписать формулы:
а) оксидов
б) оснований
в) кислот.
Дать веществам названия.
HF, N2O3, KOH, HNO3, H2O, Mg(OH)2, H2SiO3, Na2O
- Расставить степени окисления элементов во всех веществах.
НУВ на «3»
- Из перечисленных соединений выписать формулы:
а) оксидов
б) оснований
в) кислот.
Дать веществам названия.
Li2O, HI, NaOH, HNO2, Al2O3, H2SO4
- Расставить степени окисления элементов во всех веществах.
3. Рефлексия.
Учитель: Ребята, кому понравилось сегодня работать на уроке?
Как вы считаете, достигли мы своей цели?
Что бы вам хотелось изменить в ходе урока?
4. Домашнее задание
НУВ параграф 20, задание № 4
СУВ параграф 20, задание № 4, расставить во всех веществах степени окисления.
ВУВ составить кроссворд по теме.
Литература:
- П.И. Воскресенский «Справочник по химии», М, Просвещение, 1978 г
- О.С. Габриелян «Химия 8 класс», М, Дрофа, 2005 г.
- Б.В. Мартыненко «Кислоты - основания», М, Просвещение, 1988 г.