Царство науки не знает предела -
Всюду следы её вечных побед.
Разума слово и дело,
Сила и свет.
Цели урока:
- Сформировать понятие об электролизе, как о физико-химическом процессе; установить связь между элементами содержания ранее изученного материала на уроках химии.
- Показать возможности использования электролиза в промышленности.
- Развивать логическое и абстрактное мышление; формировать навыки анализа источников информации, развития устной речи.
- Развивать навыки работы на компьютере.
Подготовка к уроку
- Оборудование: источник тока ВС 4-12, лампочка на 4 в, угольные стержни, раствор медного купороса, ключ, провода.
- На партах конспект к уроку.
Электрический ток в жидкостях |
||||
Среда |
Свободные носители электрических зарядов |
Экспериментальное подтверждение |
Закон |
Пояснения |
Электролиты |
положительные и отрицательные ионы |
|
Электролиза (закон Фарадея)
масса вещества выделившегося на электроде |
k - электрохимический эквивалент
k - отношение массы иона к его заряду |
Задачи |
№1. При серебрении изделия пользовались током 5А в течение 15 мин. Какое количество серебра израсходовано за это время? |
№2. При каком токе протекал электролиз в растворе медного купороса, если за 5 мин на катоде выделилось 6 г меди? |
№3. Какой разряд должен пройти через раствор сернокислой меди, чтобы на катоде отложилось 6,58 г меди? |
№4. За сколько времени полностью израсходуется медный анод, размеры которого 100*50*2 (мм3), при условии. Что ток в ванне 3,0 А? |
№5. При электрическом способе получения никеля расходуется 10кВт энергии на 1 кг. Электрохимический эквивалент никеля 3*10-7 кг/Кл. |
№6. Сколько алюминия выделятся при затрате 1 кВт/ч электрической энергии, если электролиз ведется при напряжении 5,0 В. КПД установки 80%? |
Домашнее задание § 122-123, упр. 20 (4,5) |
Ход урока
I. Организация урока
II. Повторение пройденной темы по вопросам
- Что является носителями свободных зарядов в металлах? В вакууме? Полупроводниках?
- Дайте определение силе тока.
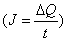
- Как найти количества электричества
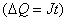
- Как определится энергия электрического поля?
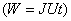
- Чему равно произведение силы тока на время?
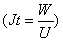
- Как определяется коэффициент полезного действия?
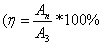 )
)
III. Изложение новой темы
Учитель. Физика и химия естественные науки, объект их изучения природные явления, в частности электролиз. Мы должны рассмотреть этот процесс, его суть и применение в технике.
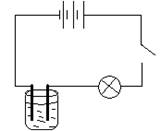
Демонстрация: Подсоединяем источник тока к угольным электродам. Погрузим электроды в раствор медного купороса. Замкнём ключ, увидим, что лампочка горит, и оставим на некоторое время.
Из курса химии вы знаете о процессе проводимости в жидкостях, что известно вам об этом?
Ученик. Проводимость в жидкостях обусловлена движением положительных и отрицательных ионов.
Учитель. Смотрим фрагменты урока «Электрический ток в жидкостях» компьютерного диска «Виртуальная школа Кирилла и Мефодия» урок физики в 10 классе и их обсуждаем.
Фрагмент Природа проводимости в жидкостях.

Рисунок 1
Обратим внимание на конспект. Итак, свободные носители электрических зарядов в растворах электролитов положительные и отрицательные ионы.
Учитель. Вернёмся к нашей установке. Вынем электроды из раствора медного купороса. Каков результат опыта?
Ученик. На одном электроде выделилась чистая медь.
Учитель. Рассмотрим процесс электролиза. Смотрим фрагмент.
Фрагмент Процесс электролиза.

Рисунок 2
На одном из электродов выделяется чистая медь, этот электрод соединён с отрицательным полюсом (катодом).
На аноде протекает процесс окисления, на катоде - восстановления. Поэтому, электролиз определяют, как окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через раствор или расплав электролита.
Учитель. При электролизе на катоде происходит выделение вещества. От чего зависит масса вещества, выделяющегося на катоде за определённое время? Это установил английский учёный Майкл Фарадей.
Историческая справка о Фарадее.
Рисунок 4
Современная наука позволяет вывести закон Фарадея теоретически. Но во времена Фарадея не существовало электронной теории и даже самого понятия об электроне. Более того, именно закон, полученный Фарадеем опытным путём, послужил толчком к выдвижению гипотезы о существовании в природе элементарной порции электричества.
Фрагмент Закон электролиза.
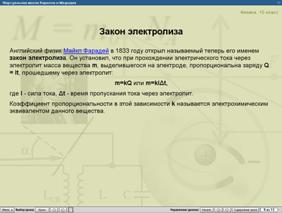
Рисунок 5
Учитель. Выведем закон Фарадея, опираясь на наши знания.
Масса выделившегося на катоде вещества равна:
m=moiNi, где mi – масса иона, а Ni число ионов, но moi=![]() , М – молярная масса, NA – число Авогадро.
, М – молярная масса, NA – число Авогадро.
Ni= ![]() где
где ![]() заряд иона qoi= ne, n – валентность.
заряд иона qoi= ne, n – валентность.
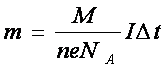
![]()
![]()
![]()
Электрохимический эквивалент равен отношению массы иона к его заряду. Посмотрим в конспект. У нас записан закон Фарадея и электрохимический эквивалент. Для каждого вещества электрохимический эквивалент разный.
Работа с таблицей в «Сборнике задач по физике» А. П. Рымкевича
Таблица № 10 стр. 165, найти электрохимический эквивалент меди, серебра, никеля.
В век наш стремительный
Знанья нужны.
К делу приложены знанья должны.
Вот электролиз мы учим опять
Где же мы сможем его применять?
Мир применения очень велик
Вечный гербарий, бижутерия – шик.
А кружева из металла – мечта!
В мире царим ведь всегда красота.
Ну а теперь по серьёзней дела,
Чистых металлов получена тьма,
Газ: кислород, водород, фтор и хлор,
И от коррозии крепкий запор.
Рассмотрим применение электролиза на практике. Электролиз получил широкое распространение.
Гальваностегия (от Гальвании и (стеге) – покрытие-) нанесение на поверхность изделия тонкого металлического покрытия из цинка, никеля, хрома, меди, свинца. Эти металлы защищают изделие от коррозии и механического износа, повышают их твёрдость. Наносят на покрытие, обладающее заранее заданными техническими характеристиками, скажем, определённой электропроводностью.
Методами гальванопластики (от Гальвани и (пластики) - лепка) на поверхности изделия осаждают толстый слой металла, который легко отделяется от формы и хорошо производит рельеф. Так делают детали из металлов с трудом поддающихся традиционной обработки. С помощью гальванопластики изготавливают печатное клише, валики для теснения кож. Гальванопластическим способом можно выполнять множество интересных работ, делать обычные кружева металлическими и ими украшать деревянные изделия, изготавливать филигранные, ажурные подстаканники, хлебницы, создавать ювелирные изделия.
Фрагмент Гальванопластика и гальваностегия.

Рисунок 3
На уроках химии знакомились с электрометаллургией, получением чистых металлов, рафинирование металлов. Все эти примеры относятся к катодным процессам.
Фрагмент Получение веществ.

Рисунок 4
Итак, подведём итог.
- Вследствие электролитической диссоциации в растворах электролитов появляются свободные носители зарядов – положительные и отрицательные ионы.
- Растворы и расплавы электролитов обладают ионной проводимостью. В некоторых жидких проводниках существует и электронная проводимость.
- Явление электролиза состоит в том, что при протекании тока через электролит на электродах выделяется вещество. Масса вещества, выделившегося на электроде, прямо пропорциональна прошедшему через электролит заряду.
- Электролиз получил широкое применение в технике. Его используют в гальваностегии и гальванопластике, в электрометаллургии.
Учитель. Мы сегодня расширили границы имеющихся у вас знаний по электролизу, познакомились с законом Фарадея, применением электролиза. Знать теорию мало, надо уметь применять её при решении задач.
IV. Проверка знаний учащихся
Электрический ток в жидкостях.
1. При повышении температуры удельное сопротивление раствора электролиза
Не изменяется
Увеличивается
Уменьшается
Может уменьшаться или увеличиваться
2. Процесс образования ионов при растворении веществ в жидкостях
Ионизацией
Электрической диссоциацией
Термоэлектронной эмиссией
Фотоэффектом
V. Решение задач из опорного конспекта
Задачи в конспекте расположены в порядке усложнения материала. При решении необходимо использовать все имеющиеся у вас знания. За консультацией при решении задач нужно обращаться к учителю. Для решения необходимо пользоваться таблицей электрохимических эквивалентов.
-
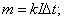 m=0,005кг .
m=0,005кг . 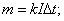
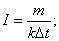 I=60,6 A
I=60,6 A 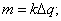
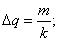


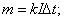
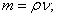
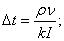
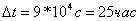
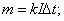
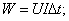
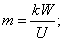
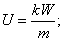 U=10,8B
U=10,8B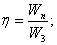
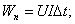
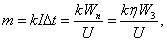 m=0,054 кг.
m=0,054 кг.
VI. Домашнее задание
Физика 10 класс Г. Я. Мякишев, Б. Б. Буховцев, Н.Н. Сотский §119, 120. Упражнение20 (4, 5).
VII. Итоги урока
Что понравилось на уроке? Что было неудачным по вашему мнению? О чём хотелось бы узнать больше?
Литература
- Компьютерный диск «Виртуальная школа Кирилла и Мефодия» Уроки физики в 10 классе.
- Г. Я. Мякишев, Б. Б. Буховцев, Н. Н. Сотский Физика 10 класс. Учебник для образовательных учреждений М.: Просвещение 2006 г.
- Энциклопедия для детей физика – М.: Аванта, 1998 г.
- Хрестоматия по физике – под ред. Б. П. Спасского – М.: Просвещение, 1982 г.
- Газета « Физика» Издательский дом «Первое сентября» № 10 2006 г., № 5 2004 г.