Цели:
Образовательная:
- Наблюдая, что происходит с расплавами и растворами солей при электролизе, научиться объяснять происходящие процессы на электродах, составлять уравнения химических реакций.
- Закрепить правила:
- восстановления катионов на катоде;
- окисления анионов на аноде;
- Узнать о применении электролиза в химической промышленности.
Развивающая: совершенствовать умения учащихся анализировать, сравнивать, наблюдать, делать выводы, устанавливать взаимосвязь между физическими и химическими процессами.
Воспитательная: продолжать воспитывать у учащихся культуру умственного труда, положительного отношения к знаниям и их применению в жизни.
Оборудование: персональный компьютер, интерактивная доска, диск с кинофрагментами “Химия и электрический ток”.
Актуализация знаний в ходе проверки основных понятий.
Учитель на интерактивной доске показывает основные понятия, которыми пользовались обучающиеся при изучении темы “Окислительно-восстановительные реакции”, и показывает основные понятия, с которыми обучающиеся будут работать в теме данного урока.
Учитель отмечает знакомые понятия (синий цвет), которые в ходе урока будут дополнены новой информацией.
| Основные понятия для
темы: “Окислительно-восстановительные реакции”. |
Основные понятия для
темы: “Электролиз расплавов и растворов солей”. |
| - Окислительно-восстановительные реакции | - Электролиз - Электролизёр |
| - Электрохимический ряд напряжения металлов; | - Электрохимический ряд напряжения металлов; |
| - Катод | - Катод |
| - Анод | - Анод |
| - Катионы | - Катионы |
| - Анионы | - Анионы |
| - Процесс окисления | - Процесс окисления |
| - Процесс восстановления | - Процесс восстановления |
Как вы уже поняли, что при изучении данной темы мы будем пользоваться понятиями, которые вам уже известны по теме ОВР, дополним их новой информацией и узнаем несколько новых понятий.
Изучение нового материала:
Итак, ребята, на прошедшем уроке мы теоретически рассмотрели процессы, происходящие при электролизе,познакомились с такими понятиями как: электролиз, электролизер, характеристикой электродов.
Фронтальный опрос.
- Какой процесс называется электролизом?
- Дайте характеристики катоду и аноду.
- Какие виды анодов вы знаете? Чем они отличаются друг от друга?
- Что такое электролизёр?
- Какие частицы называются катионами и анионами?
- Какие процессы называются окислением, а какие – восстановлением?
Также мы рассмотрели с вами электролиз расплавов.
Сегодня мы продолжим изучение данной темы, практически применяя полученные знания, и подробно рассмотрим электролиз растворов солей.
Итак, тема нашего урока:
“Электролиз растворов солей. Применение электролиза”.
Открыли тетради и записали тему урока.
Давайте вспомним, как происходит электролиз расплавов солей.
Рассмотрим схему электролиза расплава бромида натрия. Учащийся записывает схему электролиза расплава на доске, остальные в тетрадях на местах.
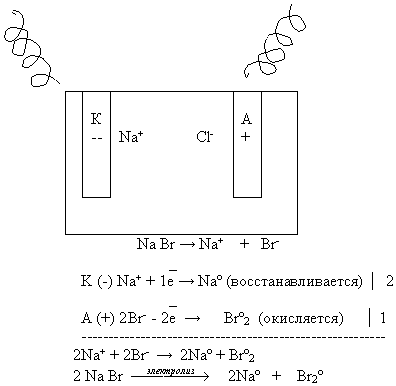
Вывод:
При электролизе расплава электролита:
Какие металлы можно получить электролизом расплавов солей?
(Щелочные, щелочно-земельные, алюминий – электролизом расплава оксида в криолите).
Итак, мы выяснили, какие процессы протекают при электролизе расплавов.
А теперь продолжим изучение темы и рассмотрим электролиз растворов солей.
Давайте вспомним порядок разрядки катионов и анионов на инертных электродах, с которым мы с вами познакомились на прошлом уроке.
- Перечислите правила восстановления катионов на катоде.
- Перечислите правила окисления анионов на аноде.
Рассмотрим электролиз раствора сульфата меди ( II)
Учитель демонстрирует видеофильм “Электролиз раствора сульфата меди (II )”.

После просмотра видеофильма учитель задает вопросы:
- Какой газ выделялся на катоде?
- Почему анод приобрел красный цвет?
- Какой раствор содержится в электролизере после окончания электролиза?

Выделение меди на аноде
В каждом химическом процессе, существуют свои закономерности (это законы Фарадея). Мы их уже рассмотрели в виде правил на прошлом уроке и повторили сегодня.
Опираясь на эти правила, запишем схему электролиза раствора сульфата меди (II ) на доске и в тетрадях.
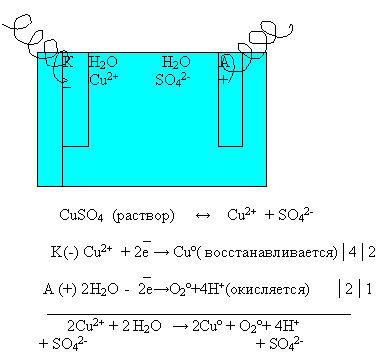
Суммарное уравнение электролиза раствора сульфата меди (II):
Вывод: из раствора сульфата меди( II) на катоде будут восстанавливаться катионы меди (Cu 2+), а на аноде будут окисляться молекулы воды.
Показ видеофильма “Электролиз раствора иодида калия.
- Почему произошло изменение окраски фенол-фталеина в катодном пространстве?
- Какое вещество выделилось на аноде?
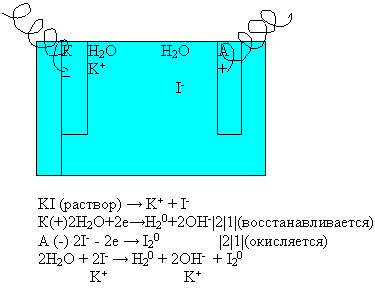
Суммарное уравнение электролиза раствора иодида калия:
![]()
Вывод: при электролизе раствора иодида калия на катоде из молекул воды будет восстанавливаться водород, а на аноде будут окисляться ионы йода.
Показ видеофильма “Электролиз раствора сульфата калия”.
- Какие газы выделяются на аноде и катоде?
- Какие вещества образуются в катодном и анодном пространстве?
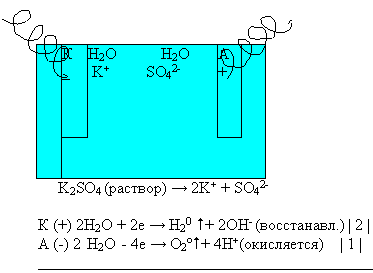
Суммарное уравнение электролиза раствора cульфата калия:
![]()
Вывод: при электролизе раствора сульфата калия электролизу подвергаются только молекулы воды.
Общий вывод: при электролизе растворов солей:
- Процессы восстановления, протекающие на катоде с катионами (см по электрохимическому ряду напряжений металлов)
- Процессы окисления, протекающие на аноде с анионами (см. по ряду окисления анионов).
6. Применение электролиза.
Применение электролиза (презентация обучающегося) Приложение 1.
(с текстовым приложением).
7. Закрепление знаний.
Выполнение тестированного задания. Приложение 2.
Тест составлен на два варианта.
Проверка теста.
8. Вывод по уроку:
Мы познакомились с одним из важнейших процессов, который изучается и наукой физикой (законы Фарадея), и наукой химией – это электролиз. Процессы, протекающие на электродах, находят широкое применение в промышленности. И надо обладать прочными знаниями, чтобы знать, что за вещество восстановится на катоде и окислится на аноде, а что за вещество останется в электролизере после электролиза. Для этого надо хорошо повторить и закрепить материал дома.
9. Домашнее задание:
Учебник О.С.Габриеляна, Г.Г.Лысова Химия. 11 класс.
Читать по учебнику с 217-222.
Задание №1. Напишите уравнения электрохимических процессов, протекающих при электролизе водных растворов:
- бромида калия;
- нитрата серебра.
Задание №2. В 400 г воды растворили 46,8 г хлорида натрия. Через раствор пропустили электрический ток и собрали 2,24 л хлора (н.у.). Определите массовую долю хлорида натрия в растворе после электролиза.