Цели:
обучающая
- изучить способы получения и собирания водорода
- повторить строение атома, химическую применять алгоритм изучения свойств элементов на примере связь
- уметь составлять уравнения химических реакций
- повторить понятие "изотопы"
развивающая
- развитие речи (обогащение и усложнение словарного запаса при использовании химической номенклатуры)
- развитие научного мышления: умения сравнивать, проводить анализ, прогнозировать , делать выводы
- развитие наблюдательности
- развитие экспериментальных умений и навыков
воспитательная
- воспитание дисциплинированности, аккуратности, терпимого отношения к ошибкам товарищей, умения слушать собеседника.
Методы обучения: репродуктивный, частично-поисковый, использование ИКТ.
Формы организации познавательной деятельности: фронтальная, индивидуальная, групповая.
Задачи:
- рассмотреть строение атома и молекулы водорода
- формы нахождения водорода в природе
- изучить физические свойства водорода, способы его получения и собирания
- научиться распознавать водород.
Оборудование и реактивы: аппарат Киппа, приборы для получения газов, пробирки, спиртовки, спички, мыльный раствор, лабораторный штатив, цинк, растворы серной и соляной кислот, мультимедийная презентация.
Ход урока.
Учитель: Используя оксид ртути (II) запишите уравнения реакций с помощью которых можно осуществить следующие превращения. Назовите вещества и укажите тип реакций.
HgO ![]() O2
O2 ![]() H2O
H2O ![]() H2
H2
Учитель: При разложении воды, кроме кислорода образуется газ – водород.
Водород – самый распространенный элемент в космосе. Основная масса звезд состоит из водорода: Юпитер, Сатурн – 92% Н, 8 % Н е, 0,1 % все остальные химические элементы; водород преимущественно составляет межзвездное вещество. Водород входит в состав основного вещества Земли – воды. Если посмотреть на схему распространения химических элементов, то можно увидеть, что доля водорода в земной коре составляет около 1% ее массы. Однако, роль его в природе определяется не массой, а числом атомов, доля которых составляет около 17%.
Множество органических веществ, представляют собой соединения водорода с углеродом – нефть, природный газ метан СН4, углеводы, белки, жиры, нуклеиновые кислоты, витамины и другие органические вещества. В теле человека около 10% водорода.
Учитель: Никто не знал, сколько водороду лет, хотя он сам утверждал, что родился в 1766 году в семье Генри. Но злые языки говорили, что был он в этой семье приемышем и отца его звали то ли Теофаст или Гельмонт, то ли Роберт или Джозеф, то ли Михайло или Николя, но никак не Генри. Эти же языки шепотом добавляли, что мальчика называли тогда иначе, настоящее имя он получил от своего учителя Антуана, который и ввел юношу в “большой мир”.
Водород был известен еще в XVI в. Теофрасту Парацельсу (1493-1541), его получали также Ван - Гельмонт (1577-1644), Роберт Бойль (1627-1691), Николя Лемери (1645-1715), Михаил Васильевич Ломоносов (1711-1765), Джозеф Пристли и другие ученые. В 1766 году известный английский ученый Генри Кавендиш получил “искусственный воздух” действием цинка, железа или олова на разведенную соляную или серную кислоту. Это было совершенно новое вещество, которое хорошо горело и получило название “горючего воздуха”. Но лишь в 1787 году Лавуазье доказал, что этот воздух” входит в состав воды и дал ему название “ гидрогениум”, т. е. “рождающий воду”, “водород”.

Водород – первый химический элемент периодической системы химических элементов Д.И. Менделеева. Атомный номер водорода – 1, относительная атомная масса равна 1,008. В ядре атома водорода один протон, масса которого равна 1 а. е. м. Почему же масса химического элемента водорода равна 1,008 а. е. м? Масса не равна единице, так как кроме обычного водорода, называемого протий, существуют изотопы водорода с большей массой: дейтерий и тритий.
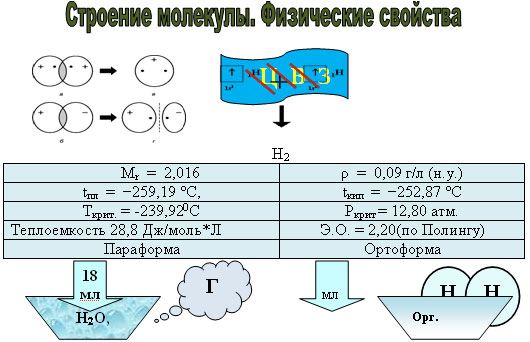
Молекула водорода двухатомна. При образовании 1 моль Н2 из 2 моль атомов Н выделяется 436 кДж. В молекуле атомы связаны одной электронной парой Н : Н или Н -Н.В рамках метода молекулярных орбиталей прочность молекулы Н2 объясняется тем, что в ней электронная пара занимает связующую - орбиталь.
Учитель: Продолжаем работать. Познакомимся с основными способами получения водорода.
1. В промышленности:
- 2NaCl + 2H22O → H2↑ + 2NaOH + Cl2
- СН4 + 2Н20 = CO2 + 4Н2 — 165 кДж
- H2O + C ⇄ H2 + CO
- CH4 + H22O ⇄ CO + 3H2 (1000 °C)
- 2CH4 + O2 ⇄ 2CO + 4H2
- Крекинг и реформинг углеводородов в процессе переработки нефти
2. В лаборатории:

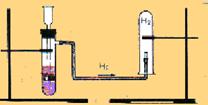
- Zn + 2HCl → ZnCl2 + H2↑
- Ca + 2H2O → Ca(OH)2 + H2↑
- NaH + H2O → NaOH + H2↑
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
Учитель: Применение водорода:
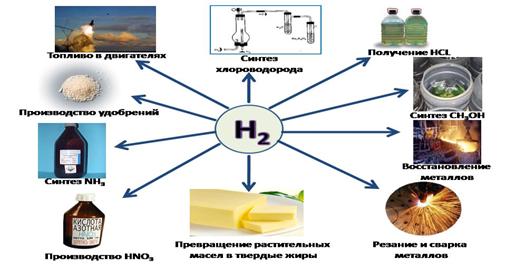
Учитель: Итог нашего урока: мы познакомились со вторым после кислорода элементом в химии – водородом. Вы узнали его свойства и уникальность. Я думаю, вам понятно, почему надо обращаться с газом очень осторожно. Возможен взрыв, вот почему вы должны быть всегда начеку!
Закрепление изученного: просмотр презентации