Цели урока:
- обучающая: рассмотреть электронное строение алюминия; изучить основные физические свойства этого металла; опираясь на знания зависимости свойств металлов от строения их атомов, предсказать характерные химические свойства алюминия;
- развивающая:продолжать развивать интерес к предмету;
- воспитывающая: продолжать воспитывать чувство ответственности.
Оборудование и реактивы: железная деталь, алюминиевая проволока, алюминиевая фольга, алюминиевые кастрюля и половник; пробирки, реактивы на демонстрационном столе:
- Al+HCL ->
- Al+NaOH ->
- CuSO4+AL ->
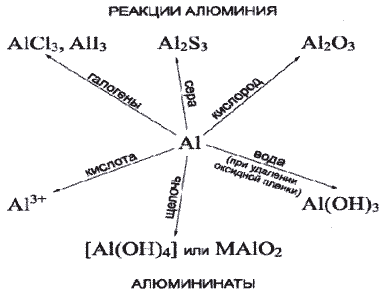
На столах у учащихся: Al, пробирки. Схемы "свойства алюминия"
| 1 ряд | 2 ряд | 3 ряд |
| CuSO4 | CuCL2 | CuSO4 |
| HCL | H2SO4 | H2SO4 |
Основная часть урока.
Во многих популярных книгах по химии приводится легенда о том, что некий мастер, имя которого история не сохранила, принес римскому императору Тиберию чашу из металла, напоминающего серебро, но более легкого. Подарок стоил жизни изобретателю: Тиберий приказал казнить его, а мастерскую уничтожить, поскольку боялся, что новый металл может обесценить серебро императорской сокровищницы.
На этом уроке мы с вами выясним, что это был за металл. Каковы его физические и химические свойства и где этот металл применяется в нашей жизни.
Сейчас вы посмотрите на этот химический элемент, его строение атома и определите тему нашего урока.
Итак, тема нашего урока - алюминий.
Записывают число и тему урока. На доске вывешивается: хим. символ - алюминия, его электронное строение.
Его называют металлом 20 в. Официально открыл его нем. ученый Велер и датск. Физик Эрнстед в 1825 г. из-за трудности его получения он стоил в 1500 раз дороже железа, а через 30 лет кг. Этого металла стоил дороже золота.
AL - очень дорогой металл, но сейчас его цена упала, потому что изменился способ получения - сейчас AL получают электролизом:
2 AL2 O 3 -> 4 AL+3O2![]()
В 19 в. Русскому императору на День рождения французская академия наук сделала царский подарок: столовый набор, состоящий из AL кружки, ложки, вилки и чашки.
Теперь, когда мы определили что этот металл- AL мы с вами дадим характеристику этого химического элемента по положению в ПС.
1 ученик дает характеристику.
Мы с вами знаем, что от строения вещества зависят его свойства. А каковы физические свойства AL ?
1 ученик делает сообщение о физ свойствах.
Алюминий - очень активный металл. Который широко используется в быту в чистом виде. Этот факт объясняется очень просто - алюминий покрыт тонкой, но очень прочной пленкой своего оксида AL2O3.
На столах у учащихся схема "свойства алюминия"
На столах у вас карточки-схемы.
Рассмотрим, в какие реакции, с какими веществами вступает алюминий,ведь это металл.
Учащиеся перечисляют хим. свойства; а учитель показывает по схеме у доски.
1) Все ли реакции нам известны? Алюминий - это металл, оксид и гидроксид которого обладают амфотерными свойствами. Поэтому алюминий растворяется в водных растворах щелочей, образуя соли - алюминаты.
1 ученик показывает дем. опыт, учащиеся проделывают его в группах.
Учитель записывает уравнение на доске.
2AL+ 2NaOH+6 H2O <->2 Na [AL(OH)4] +3 H2
Тетрагидроксоалюминат натрия
Na [AL(OH)4]- Na+ + [AL(OH)4]-
2) + HCL
1 ученик показывает дем. опыт, учащиеся проделывают его в группах.
2 AL+6HCL ->2 ALCL3 +3H2^
3) реакция замещения.
1 ученик показывает дем. опыт, учащиеся проделывают его в группах.
3 CuCL2 + 2 AL -> 2 ALCL3 + 3 Cu![]()
4) Эти кислоты перевозят в алюминиевых цистернах.
AL+ H2SO4 (конц.) ->
AL+ HNO3(конц.) ->
Мы с вами рассмотрели строение, физические и химические свойства, получение металла.
А где же в нашей жизни применяется этот металл. Помогут нам в этом Наташа и Саша.
Сценка
Я - прочный, мягкий и красивый,
Кое-где почти не заменимый.
Могу летать я в небесах.
Могу мешать картофель в щах.Ты храбриться погоди -
Что-то будет впереди!
Велика моя семья:
В самолетах - это я.
На Тобольской ТЭЦ, друзья,
Самый важный тоже я.
Кто здесь лампочки зажег?
Я несу в проводке ток.Я с коррозией на "ты".
Я добрался до звезды.
В космос я людей унес:Ты не очень задавайся,
Вот согни-ка, постарайсяЧто ж половником гремел?
Что ж ты каши мало ел?
Где же сила, брат твоя?
А теперь смотри, как я !Задирай не очень нос.
Погодите-ка друзья, что-то слишком много "Я".
Как вы думаете, где еще в нашей жизни может применяться или применяется этот металл?
Сообщения учащихся о применении алюминия в годы ВОВ.
А знания, полученные на уроке мы сейчас с вами проверим с помощью теста:
Тема "Алюминий"
1. Какой ряд чисел соответствует распределению электронов по энергетическим уровням в атоме алюминия:
а) 1,8,8.
2) 2,8,8,3.
3) 2,8,3.
4) 2,18,8,3
2. Какой из перечисленных элементов проявляет наиболее выраженные металлические свойства?
а) магний
б) кремний
в) натрий
г) хлор
3. В реакции с серой алюминий:
а) восстановитель и отдает 3 электрона
б) окислитель и принимает 3 электрона
в) восстановитель и отдает 6 электронов
г) окислитель и принимает 6 электронов.
4.Степень окисления атома алюминия:
а) +1
б) +3
в) +5
г) -3
5. Общая формула гидроксидов элементов, относящихся к 3 группе главной подгруппе:
а) НЭО
б) Э(ОН) 3
в) ЭОН
г) Э(ОН) 2
6. При взаимодействии алюминия с водой выделяется:
а) оксид алюминия и вода
б) оксид алюминия и водород
в) гидроксид алюминия
г) гидроксид алюминия и водород
7. Напишите уравнение реакции между алюминием и соляной кислотой, расставив коэффициенты методом электронного баланса. Коэффициент перед восстановителем равен:
а) 1
б) 2
в)4
г)6
Если остается время, то предложена цепочка превращений.
Дом. задание: параграф 13 (до соединений алюминия), упр. 1.3,7.