Цели урока.
- Образовательная - в ходе урока обеспечить формирование новых знаний учащихся об аммиаке, его строении, свойствах, получении и применении.
- Рассмотреть строение молекулы аммиака. Познакомить учащихся с водородной связью. Изучить свойства аммиака. Рассмотреть донорно-акцепторный механизм образования химической связи
- Развивающая - умение сравнивать, обобщать, развивать мышление, интерес к предмету.
- Воспитательная - поведение в кабинете химии, наблюдательность при просмотре видеосюжета, формировать информационную и коммуникативную культуру.
Оборудование. Аммиачная вода, кристаллические NH4Cl и Ca(OH)2, фенолфталеин, прибор для получения газов, HCl (конц), KMnO4 (для получения О2), KI, крахмал, лакмусовая бумажка, кристаллизатор, цилиндр, стеклянные палочки, лабораторный штатив.
ХОД УРОКА
I. Актуализация опорных знаний.
Проводим химическую разминку.
а) назовите возможные степени окисления азота,
б) в каких случаях азот будет проявлять окислительные свойства, и в каких - восстановительные?
в) перечислите физические свойства азота.
г) в чем причина химической инертности азота?
д) при каких условиях азот вступает в реакции с другими веществами?
е) в каком виде азот встречается в природе?
з) какова роль азота в жизни природы?
II. Изучение нового материала.
1. Строение молекулы.
Открывая дверцу холодильника, вы ощущаете холод. Так какое же вещество является причиной этому явлению?
Работа в парах.
Инструкция №1.
1. Напишите уравнения реакции водородных соединений азота.
2. Изобразите электронную и структурную формулу этого соединения.
3. Определите химическую связь в этой молекуле.
4. Какую особенность электронного строения вы видите у атома азота?
Учащиеся работают самостоятельно в парах с учебником с.47-48
Затем, проверяем правильность выполненного задания через мультимедиa (слайд №1, 2, 3 и 4) Презентация.
2. Определить физические свойства аммиака.
Проблемный вопрос. В чем причина хорошей растворимости аммиака в воде?
Беседа:
Кристаллическая решетка аммиака- молекулярная; молекула легкая, но в отличие от молекулы азота - полярная.
Отсюда, какие температуры кипения и плавления должен иметь аммиак?
Учащиеся: можно предположить, что - низкие.
Почему?
Потому, что полярность молекулы дает возможность подключать электростатические силы притяжения к просто межмолекулярным силам.
Строение молекулы позволяет прогнозировать и хорошую растворимость в воде.
Это связано с возникновением между его молекулами особой химической связи- водородной. (слайд №5). У атома азота имеется свободная электронная пара в молекуле аммиака, наличие частичного (+) заряда на атоме водорода и наличие частичного (-) заряда на атоме азота.
![]()
Водородной называется связь между атомами водорода одной молекулы и атомами электроотрицательных элементов другой молекулы (F, O, N). (слайд№5)
Вывод: аммиак при повышении давления переходит в жидкое состояние. Испарение жидкого аммиака при понижении давления сопровождается сильным охлаждением окружающих предметов. Используется это свойство в холодильных установках.
- Аммиак- бесцветный газ.
- От него во рту першит.
- Щиплет нос и щиплет глаз.
- Аммиак - он ядовит!
- Аммиак - он растворитель.
- С газа в жидкость переходит
- Аммиак - диамагнит.
- Так же ток он не проводит.
- Сухой аммиак
- На воздухе взрывается.
- В воде растворяется.
- Взрывчатые вещества, удобрения
Вот не полный список его применения.
3. Получение аммиака в лаборатории.
Демонстрируем опыт. Нагреваем смеси хлорида аммония с гидроксидом кальция.
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + H2O
Полученный аммиак растворяем в воде, в которую добавляем фенолфталеина. Раствор аммиака окрашивается в малиновый цвет.
![]()
Почему раствор аммиака окрасился в малиновый цвет?
Учащиеся: в растворе присутствует ион гидроксида, среда щелочная.
Учитель. В аммиачной воде большая часть аммиака содержится в виде молекул NH3, равновесие смещено влево, (т.к. NH3 - слабый электролит)и такая вода содержит много молекул NH3, поэтому она пахнет аммиаком. Показываю, как правильно обращаться с растворами сильно пахнущих веществ.
Демонстрируем обесцвечивание окрашенной фенолфталеином аммиачной воды при нагревании. Почему это произошло?
Учащиеся: непрочное соединение.
При нагревании растворимость газов (NH3-газ) уменьшается, аммиак улетучивается, равновесие реакции еще больше смещается влево, гидроксид-ион (ОН ) практически не остается в растворе. Водный раствор становится нейтральным.
Проблемный вопрос: из какого сырья и какими способами можно производить азотные удобрения?
Учащиеся предполагают, что из азота воздуха.
Задача эта была выдвинута перед отечественной наукой Д.И.Менделеевым, который писал : "Одну из задач прикладной химии составляет отыскание технически выгодного способа получения из азота воздуха его соединений, заключающих ассимилируемый азот. Будущность сельского хозяйства много зависит от открытия подобного способа".
Экономически наиболее выгодный способ промышленного связывания атмосферного азота - синтез аммиака из азота и водорода:
![]()
Учитель: Дайте характеристику данной реакции.
Учащиеся:
- экзотермическая
- обратимая
- каталитическая
- гетерогенная
- с уменьшением объема
Учитель: какие условия смещения равновесия необходимо для увеличения выхода аммиака?
Учащиеся: уменьшение температуры, увеличение давления.
Выход аммиака невелик, и вести промышленный синтез с такими показателями нерентабельно.
Обсуждаем с учащимися вопрос о возможностях повышения практического выхода аммиака. Важным критерием эффективности производства является производительность реактора. Анализ количественных данных о росте концентрации аммиака в азото - водородной смеси по мере протекания реакции позволяет прийти к в ы в о д у: производительность реактора можно увеличить путем уменьшения времени реакции. При этом снижается выход аммиака за один проход газовой смеси через реактор, а непрореагировавший газ можно снова вернуть в производство. Таким образом, идея циркуляции - важный технологический принцип, экономически целесообразный, повышающий производительность реактора. Необходимы требования к качеству сырья, в нем должно содержаться возможно меньше таких примесей, как аргон, метан. Сырье должно быть тщательно очищено от ядовитых для катализатора веществ(например, от соединений серы). Катализатором для синтеза аммиака является железо, активированное добавками(оксидами алюминия и калия) для придания высокой стабильной активности.
4. Образование катиона аммония идет по донорно-акцепторному механизму.
Атом азота имеет свободную электронную пару, за счет которой и формируется еще одна ковалентная связь с катионом водорода, переходящего к аммиаку от молекул воды или кислот. (слайд № 6)
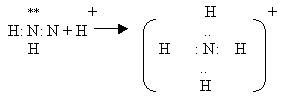
К молекуле аммиака по этому механизму присоединяется катион водорода +Н из молекулы воды и образуется ион +NH4, в котором три ковалентные связи образуются по обменному механизму, а четвертая - по донорно- акцепторному механизму. Тем не менее все связи равноценны.
5. Химические свойства.
а) растворимость аммиака в воде.
Демонстрируем опыт: наполненную аммиаком пробирку опускаем в кристаллизатор с водой, в которую добавили немного фенолфталеина. Вода быстро заполняет пробирку, а раствор аммиака окрашивается в малиновый цвет.
Растворимость аммиака в воде очень велика- в 1 объеме воды растворяется 700 объемов аммиака. Почему аммиак хорошо растворяется в воде?
Учащиеся. Причина - образование водородных связей.
Учитель: какую среду имеет водный раствор аммиака?
Учащиеся: щелочную.
Учитель: так какими же свойствами должен обладать водный раствор аммиака?
Учащиеся: основными.
Какой вывод из этого мы можем с вами заключить?
Вывод: водный раствор аммиак является основанием.
![]()
Учитель: если водный раствор аммиака основание, то с какими веществами он будет взаимодействовать?
Учащиеся: с кислотами.
Демонстрируем опыт: "дым без огня", подносим друг к другу две стеклянные палочки, смоченные концентрированными растворами аммиака и соляной кислоты. Между этими палочками появляется обильный дым.
Напишите в полном и кратком ионном видах уравнения реакцию водного раствора аммиака с соляной кислотой.
Один ученик записывает уравнение реакций у доски, затем проверяем записи в своих тетрадях.
NH3 +HCl = NH4Cl
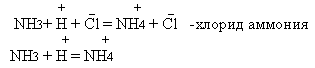
Учитель: какая соль образовалась и дать ей название?
Учащиеся дают название этой соли.
Образование катиона аммония при взаимодействии с кислотами идет по донорно- акцепторному механизму.
Обращаем внимание учащихся, что донором является азот, а акцептором- водород, т.к. у азота имеется свободная электронная пара, а у водорода свободная орбиталь.
В аммиаке азот имеет низшую с.о. (-3).
Так, чем же будет являться аммиак в окислительно-восстановительных реакциях?
Смотрим видеосюжет взаимодействие аммиака с кислородом (с катализатором и без него).
После просмотра видеосюжета прошу ребят написать уравнения реакций с кислородом, проставить с.о. и коэффициенты методом электронного баланса.
Правильность написание уравнений проверяем (слайд№ 7, 8)
Вывод: азот в аммиаке имеет низшую с.о. (-3), поэтому азот может только отдавать электроны, повышая свою с.о., отсюда - аммиак проявляет только восстановительные свойства. Химические свойства аммиака идут с изменением с.о. азота и с образованием ковалентной связи по донорно- акцепторному механизму.
III. Закрепление:
а) по какими признаками можно распознать аммиак? (по запаху; по окрашиванию влажной индикаторной бумаги - синеет; по появлению дыма при поднесении стеклянной палочки, смоченной концентрированной соляной кислотой).
б) какой тип реакции при взаимодействии аммиака с кислотами? (соединения)
в) написать уравнения реакции аммиака с ортофосфорной кислотой и дать названия полученных солей.
IV. Домашнее задание $17 c.52 упр.6,7,9- 1уровень; 6-11- 2 уровень. Подготовить сообщение о применении и значение аммиака.