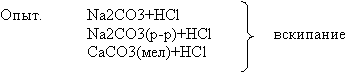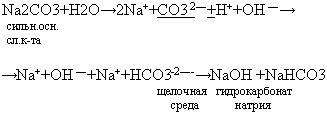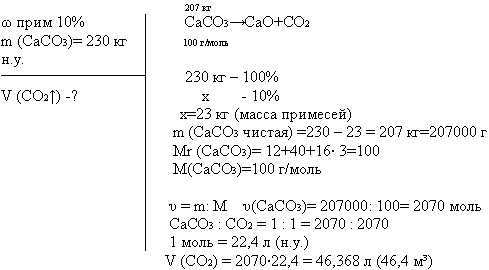Цели: изучить свойства солей угольной кислоты карбонатов и гидрокарбонатов.
Задачи:
- отработать навыки в решении расчетных и экспериментальных задачах;
- повторить свойства и строение угольной кислоты, гидролиз солей и реакции обмена;
- воспитывать коммуникативную культуру, уверенность в себе и
- знаниях, навыки контроля и самоконтроля.
Тип урока: изучение новой темы
Методические приемы: рассказ, демонстрации опытов.
Оборудование: раствор Na2CO3; раствор HCl, H2SO4, Ca(OH)2, Na2CO3 твердая, индикатор – фенолфталеин, штатив, газоотводная трубка; карточки – задания
Ход урока
1. Организационный момент
2. Проверка домашнего задания
Учитель. Сегодня на уроке мы должны изучить соли угольной кислоты. Но прежде чем отправимся в увлекательный мир карбонатов, нам надо повторить свойства и строение H2CO3.
(2 человека у доски, 3 человека на рабочем месте)
У доски
1. Дать характеристику угольной кислоте: сила, основность, содержание кислорода. Составить уравнение диссоциации.
2. Химические свойства угольной кислоты.
На месте.
1. Дать характеристику аллотропным модификациям углерода.
2. Дать сравнительную характеристику физических и химических свойств оксида углерода (VI) и оксида углерода (II): строение молекул, физические и химические свойства.3. Допишите определения:
а) адсорбция – это процесс - …
б) процесс выделения поглощенных веществ называется …
Пока ребята готовят ответы на вопрос, мы проведем небольшую письменную работу (10 вопросов)
- Разновидности простого вещества, образованного одним и тем же химическим элементом? (Аллотропные видоизменения)
- Электронная формула атома углерода. (1s22s22p2)
- Количество электронов на внешнем уровне у элементов IV группы главной подгруппы (четыре)
- Летучие водородные соединения С и Si? (СН4 – метан, SiН4 – силан)
- Формула высших оксидов элементов IV группы главной подгруппы? (RО2)
- Масса 0,5 моль СО2
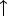 ? (22г)
? (22г) - Объем 2 моль СН4 при н.у.? (44,8 л)
- Чего больше по массе в угарном газе углерода или кислорода? (кислорода С:О = 3:4)
- Степень окисления углерода в угарном газе и углекислом газе? (+2;+ 4)
- Что такое сухой лед?
Проверка (правильные ответы на доске)
Ребята проверяют исправляют ошибки, выставляют
себе оценки.
Проверка ответов у доски: рассмотрим свойства H2CO3.
III. Объяснение нового материала
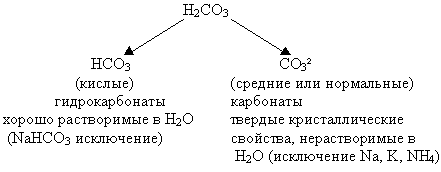
H2CO3 диссоциирует в две стадии.
Сколько типов солей образует данная соль?
(по ходу опроса записывают схему на доске)
В повседневной жизни мы часто сталкиваемся с
солями угольной кислоты (питьевая сода,
известняк, мрамор, мел и т.п.)
Списывают с доски в тетрадь тривиальные названия
солей.
Стихотворение о карбонатах. (пока учащиеся пишут)
На земле живут три брата
Из семейства карбонатов.
Старший брат красавец – мрамор.
Славен именем каррары
Превосходный зодчий. Он
Строил Рим и Парфенон.Всем известен известняк
Потому и назван так.
Знаменит своим трудом
Возводя за домом дом.И способен и умел младший
Мягкий братец мел.
Как рисует посмотри
Этот …СаСО3.
CaCO3 – мел, известняк, мрамор
NaHCO3 – питьевая сода
Na2CO3 – кальцинированная сода
Na2CO3•10H2O – кристаллическая
сода
CaCO3 – жемчуг (минерал арагонит)
Получение солей: назовите лабораторный способ получения солей.
(кислота + основание ![]() соль + вода – реакция
нейтрализации)
соль + вода – реакция
нейтрализации)
Для получения солей угольной кислоты
используют ![]() C02
C02![]()
2NaOH+CO2![]()
![]() Na2CO3+H2O, если
избыток CО2
Na2CO3+H2O, если
избыток CО2![]() получаются кислые соли
получаются кислые соли
Na2CO3+CO2![]() +H2O
+H2O![]() 2NaHCO3
2NaHCO3
Химические свойства.
Отношение к нагреванию.
CaCO3![]()
![]() CaO + CO2
CaO + CO2 ![]()
CaHCO3![]() CaCO3
CaCO3![]() +CO2
+CO2![]() +H2O
+H2O
(Это свойство позволяет использовать гидрокарбонаты в пищевой промышленности в качестве разрыхлителя теста)
В результате реакций выделяется CO2![]() , как его обнаружить?
, как его обнаружить?
– лучина тухнет.
– через раствор известковой воды (Ca(OH)2)
образуется осадок белого цвета.
Ca(OH)2+CO2![]()
![]()
![]() CaCO3+H2O,
CaCO3+H2O,
но если дальше пропускать CO2![]() осадок растворяется
осадок растворяется
CaCO3![]() +CO2
+CO2![]() +H2O
+H2O ![]() Ca(HCO3)2
Ca(HCO3)2
2. Реагирует солями (тип реакций?)
Na2CO3+CaSO4 ![]() K2SO4+CaCO3
K2SO4+CaCO3
(На доске расписывает ученик полное и сокращенное ионное уравнение.)
3. С кислотами
Na2CO3+2HCl ![]() 2NaCl+CO2
2NaCl+CO2
![]() +H2O
+H2O
Наблюдение “вскипание”.
Реакция взаимодействия солей H2CO3 с
кислотами – качественная.
Геологи используют это свойство для определения
карбонатных минералов.
Самостоятельно составьте уравнения химических реакций.
4. Гидролизу подвергаются соли угольной кислоты образуя в результате кислые соли в щелочной среде.
Испытать раствор Na2CO3 индикатором фенолфталеином (раствор малинового цвета)
Вывод: соли угольной кислоты имеют общие свойства солей и специфические: 1) взаимодействие с кислотами; 2) гидролиз.
IV. Решение задачи
Какой объем СО2 выделится (при н.у.) при обжиге 230 кг известняка, содержащего 10 % примесей.
V. Подведение итогов урока (выставление оценок)
VI. Домашнее задание
§ 33, № 21-22 (с. 91–92) устно, задача 3 (с.92)