Цель: Рассмотреть природные соединения алюминия, важнейшие свойства и изучить практическое значение
Задачи:
- Образовательная: сформировать представление о природных источниках, свойствах и применении алюминия.
- Развивающая: умение работать с различными источниками информации, объективной оценки событий и самооценки .
- Воспитывающая: формирование коммуникативных качеств и чувства ответственности, аккуратности.
Тип урока: комбинированный
Метод обучения: проблемный
Организационные формы: беседа, самостоятельная работа, лабораторная работа.
Обеспечение занятия: раздаточный материал, Al металлический, неметалл – окислитель: сера, бром, кислород, растворы H2SO4, HCl, NaOH колбы, пробирки, электрическая лампочка, ключ, медная и алюминиевая пластинки.
Структура урока:
1-й этап – организационный.
2-й этап – вызов.
3-й этап – осмысление.
4-й этап – рефлексия.
Ход урока
1-й этап. Организационный .Создание комфортной обстановки и положительной мотивации. Деление участников на 6 групп.
– Здравствуйте ребята, я рада встречи с вами. Видя ваши доброжелательные лица и хорошее настроение, смею надеяться на успешное и плодотворное сотрудничество. Проверяем готовность к уроку .Достаю черный ящик с алюминиевой вилкой внутри.
“Спрятан в ящике предмет –
Без него не съесть обед,
Вещь незаменимая.
Вещь необходимая.
Если мы садимся кушать,
Тот предмет нам очень нужен
Из чего же сей предмет
Серебристо-белый цвет
Вам позволит дать ответ.”
Записываем тему урока.
2-й этап – Вызов. Используя “Пометки на полях” (Приложение 1) прочитать текст (Приложение 2) и материал учебника по работе каждой группы с материалом (природные ресурсы, строение атома, тип химической связи, тип кристаллической решетки; физические свойства алюминия, химические свойства алюминия, получение, применение) и сделать пометки на полях (работа в группах 10 мин)
Ребята ,запишите в тетради все, что вы знаете об алюминии. (1–2 мин.)
А сейчас обсудите то, что вы записали по данной теме, что хотели бы узнать. Выделите моменты совпадения и несогласия. (1-2 мин). После истечения времени составляем список идей, записываем на доске не повторяя вышеизложенные факты..
На доске записываются все верные и неверные гипотезы. Составляем кластер. Неверные гипотезы исключаем.
3-й этап – Осмысление. Заполняем сплетенную “Паутинку” полученными фактами на доске. Фронтальная беседа.
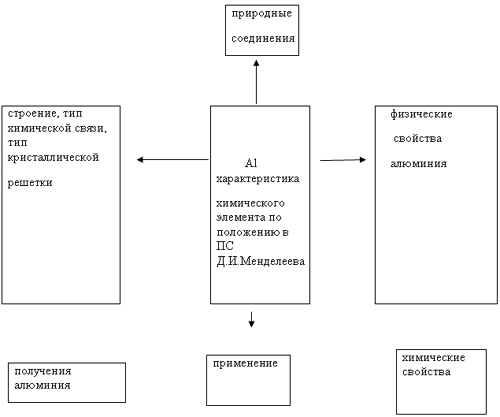
Задание: Назовите соединения алюминия о которых вы узнали из информационного
источника
Составление кластера.
Строение Al. Порядковый номер – 13. Значит заряд ядра +13. Количество отрицательно заряженных электронов находится на трех энергетических уровнях: соответственно на первом – 2; на втором – 8; на третьем – 3. Электронная формула:1s2 2s22p63s23p1. Отсюда следует, что число возможных химических связей равно – 3.Степень окисления +3. Высший оксид – Al2O3 является амфотерным, т.е. оксиду алюминия соответствует основание Al(OH)3 и ортоалюминиевая кислота H3AlO3
Парная лабораторная работа: Возьмите алюминиевую проволоку, рассмотрите её, попробуйте изменить форму. На основании наблюдения и жизненного опыта охарактеризуйте физические свойства и опишите их. В случае затруднения поставьте знак вопроса.
По окончании самостоятельной работы учитель дополняет ответы.
Демонстрационный опыт на теплопроводность:
В лапке штатива горизонтально закрепляем алюминиевую проволоку, к ней пластилином прилепляем две спички. Конец проволоки нагреваем в пламени спиртовки. Через некоторое время спички по очереди падают.
Вывод: Al – проводит тепло.
Демонстрационный опыт на электропроводность:
Собирается цепь из трех предметов: источника тока, потребителя и включаю пластинку в ключе, замыкающую цепь заменяем на Al проволоку. При замыкании цепи лампочка загорается.
Вывод: Al проводит электрический ток.
Физические свойства: Твердое вещество серебристо-белого цвета: плотность – 2,7 г/см3, Т кип = 2500 оС; Тпл.660 оС . Высокая пластичность – прокатывается в фольгу. Электро- и теплопроводен, обладает высокой теплоотражательной способностью.
Химические свойства:
Инструкция по технике безопасности:
- Соблюдайте осторожность при работе с химическими реактивами.
- При нагревании сначала прогревайте всю пробирку. Направляйте её отверстие в сторону от себя и соседей.
- При работе со спиртовкой соблюдайте осторожность ,берегитесь огня.
Парная лабораторная работа
Задание 1. Составьте уравнения реакции с простыми веществами: кислородом , бромом, серой. К полученному веществу в последней реакции добавьте воду. Закончив работу, напишите уравнение фломастером на листе бумаги и поднимите вверх. Объясните к какому типу химических реакции относятся данные реакции.
- 4Al + 3O2=2Al2O3
- 2Al + 3Br2=2AlBr3
- 2Al+3S=Al2S3
- Al2S3 +6H2O=2Al(OH)3 +3H2S
Задание 2. В две пробирки аккуратно положите два кусочкам алюминия .К первой добавили + 1 мл HCl, а ко второй 1 мл H2SO4 (конц). Подогрели. Объясните наблюдение. Составьте уравнение химической реакции на доске.
2Al + 6HCl = 2AlCl3 + H2
2Al + 6 H2SO4(конц)=Al2(SO4)3 + 3SO2 + 6H2O
Задание 3. К двум кусочкам алюминия прилили 1 мл гидроксида натрия. Подогрели. Объясните наблюдение. Составьте уравнение химической реакции на доске.
2Alо + 2NaOH + 6H2O = 2Na(Al(OH)4) + 3H2
Задание 4. Напишите реакцию восстановления железа из железной окалины с помощью алюминия. К какому типу относится данная химическая реакция?
8Alо + 3Fe2O3 = 4Al2O3 + 9Fe
Задание 5. Уравняйте уравнение разрушения оксидной пленки амальгамой ртути.
3HgCl2 +2 Al = 2 AlCl3 + 3 Hg
2Al + 6 H2O = 2 Al(OH)3 + 3H2
Вывод: Алюминий обладает восстановительными свойствами при взаимодействии с неметаллами и оксидами металлов, проявляет амфотерные свойства, при разрушении оксидной пленки реагирует с водой.
Парная работа. (Приложение 3.)
Применение:
- в электоротехнике;
- самолето,пароходо, автомобилестроении;
- термической сварки;
- в строительной промышленности (стеклопакеты и т.д.);
- для получения редких металлов и в свободном виде;
- для получения сплавов с антикоррозионными свойствами.
Получение:
Оксид алюминия растворяют в расплаве криолита Na3AlF6 c использованием графитовых электродов .Метод энергоемкий поэтому в России заводы по получению алюминия находятся на Урале, Западной и Восточной Сибири вблизи ГЭС или ГРЭС. Это Хакасский, Новокузнецкий, Братский, Красноярский металлургические комбинаты. Чистый алюминий плавится при 2050оС.не растворяется в воде ввиду наличия оксидной пленки. В результате электролиза температура понижается до 1000оСВ присутствии AlF3получается технический алюминий. Образуется AlF (одновалентный), который легко возгоняется и распадается при 800оС получается чистый алюминий.
Стадия рефлексии: (Приложение 3) Обсуждение результатов. Составление эссе об алюминии или сиквейна.
- Одним словом (сущ.) выразите тему сегодняшнего урока,
- подберите к этому слову два прилагательных,
- подберите три глагола,
- составьте фразу, в которой будет отражена значимость этого слова,
- подберите синоним этому слову.
Подведение итогов, выставление оценок.
Домашнее задание. Изучить параграф, стр. №
**Составить рекламу алюминия. **Решить задачу: Дан сплав алюминия с медью массой 270 г и массовой долей меди 20%. Теоретический выход водорода составил 85%. Вычислить массу алюминия и практический выход водорода, если сплав взаимодействует с водным раствором едкого натра.
Список литературы:
- Менсон И.А. 100 вопросов и ответов по химии.М.; Дрофа 1988.
- .Пичугина Г.А. Штремплер Г.И. 2-ое стереотипное издание М.;Дрофа, 2005.
- Химия в школе № 3 2004.
- Г.Е. Рудзитс, Ф.Г. Фельдман 9 класс М.;”Просвещение”.
- Блауберг И. В., Юдин Э. Г. Становление и сущность системного подхода. – М.: Наука, 1973. – 270 с.
- Бондаренко Е. А., Журин А. А. Состояние медиаобразования в мире. // Педагогика. – 2002. – № 3. – С. 88 – 98.
- Макареня А. А. Введение в антропоэкологию: Материалы для выполнения самостоятельной работы. – Омск: Изд-во Омского гос. университета, 1997. – 56 с.
- Российская педагогическая энциклопедия. – М.: Большая Российская Энциклопедия, 1993. – Т. 1.
- Федоров А. В. Медиаобразование: История, теория и методика. – Ростов-на-Дону: Изд-во ООО "ЦВВР", 2001.
- Concepts principaux. // Электронный ресурс: www.mediaawareness.ca/francais/ressources/educatif/outils_de_reflexion/concepts_principaux.html.