Цели урока:
- Повторить, закрепить и обобщить знания учащихся о классификациях химических реакций, скорости химических реакций, химическом равновесии, гидролизе солей.
- Развивать умение учащихся в написании уравнений химических реакций, расстановке коэффициентов методом электронного баланса и характеристике гидролиза солей.
- Воспитывать культуру поведения на уроке.
Оборудование и реактивы: На столах учащихся:
- раздаточный дидактический материал;
- мультимедиапроектор;
- презентация.
Ход урока
I. Организационный момент.
- Приветствие
- Работа с журналом.
- Объявление темы и целей урока (проецируется на слайде).
II. Повторение полученных ранее знаний.
1) Вопросы для повторения (слайд презентации):
- Какие классификации химических реакций Вы знаете?
- Приведите типы реакций по следующим признакам:
1) состав исходных и образующихся веществ;
2) изменение степени окисления;
3) тепловой эффект;
4) обратимость процесса;
5) наличие катализатора;
6) агрегатное состояние веществ.
2) Показ видеофрагмента «Получение хрома алюмотермическим способом» (слайд презентации)
3) Задание: дать характеристику реакции по всем известным классификациям (слайд презентации)
- Сr2O3 + 2AI = AI2O3 + 2Cr
- Замещение
- Окислительно-восстановительная (с изменением степени окисления)
- Экзотермическая
- Необратимая
- Некаталитическая
- Гомогенная
4) Показ видеофрагмента «Вулкан: разложение дихромата аммония» (слайд презентации)
5) Задание: дать характеристику реакции по всем известным классификациям (слайд презентации)
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
- Разложение
- Окислительно-восстановительная (с изменением степени окисления)
- Экзотермическая
- Необратимая
- Некаталитическая
- Гетерогенная
6) Вопросы для повторения. (Слайд презентации)
- Что называется окислительно-восстановительной реакцией?
- Что называется окислением?
- Что называется восстановлением?
- Что называется окислителем?
- Что называется восстановителем?
7) Расставьте коэффициенты методом электронного баланса (слайд презентации)
Zn + H2SO4(конц.) → ZnSO4 + H2S↑ + H2O
Ответ:
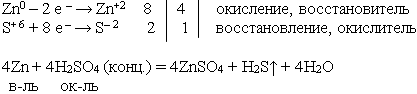
8) Скорость химических реакций. (Слайды презентации)
Вопросы для повторения.
- Что называется скоростью химической реакции?
- От чего зависит скорость химической реакции?
- Увеличить скорость реакции
4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q можно, если:
1) измельчить пирит (FeS2)
2) использовать воздух, обогащённый азотом
3) поглощать оксид серы (IV) водой
4) снижать температуру
Ответ: 1. - При комнатной температуре медленнее протекает реакция между:
1) Fe и O2
2) CaCO3 (твёрдый) и HCI (раствор)
3) NaOH (раствор) и HCI (раствор)
4) Zn и CuCI2 (раствор)
Ответ: 1.
9) Химическое равновесие. (Слайды презентации)
Вопросы для повторения.
- Какие реакции называются необратимыми?
- В каком случае они идут до конца?
- Какие реакции называются обратимыми?
- Что называется химическим равновесием?
- В чём заключается принцип Ле Шателье?
- От каких факторов зависит смещение химического равновесия?
- Дана реакция:
SO2 + H2O = H2SO3 + Q
При каких условиях равновесие сместится в сторону прямой реакции (вправо)?
Ответ:
1) Увеличение концентрации SO2 и H2O
2) Вывод продукта реакции
3) Понижение температуры
4) Повышение давления
10) Водородный показатель рН. (Слайды презентации)
Вопросы для повторения.
- Что такое рН, рОН?
- Как определяется рН, рОН?
- Концентрация раствора HNO3 равна 0,001 моль/л. Определите рН раствора HNO3.
- Концентрация раствора КОН равна 0,00001 моль/л. Определите рОН раствора КОН.
11) Электролитическая диссоциация. (Слайды презентации)
Вопросы для повторения.
1. Дана схема реакции
Ba2+ + CO32– → BaCO3↓
Какая их предложенных реакций соответствует этой схеме?
- BaCI2 и Na2SO4
- BaO и CO2
- Ba(OH)2 и CO2
- Ba(NO3)2 и Na2CO3
Ответ: 4.
12) Гидролиз. (Слайды презентации)
Вопросы для повторения.
- Что называется гидролизом?
- Как изменяется цвет индикатора? Определить среду, рН у следующих солей:
1) KNO3;
2) MgCI2;
3) Cs3PO4;
4) CH3COOK.
13) Проверочная тестовая работа. (Слайды презентации)
III. Домашнее задание: (слайд презентации)
- § 11, упр. 1, 3;
- § 12, упр. 3, 4;
- § 13;
- § 14, упр. 1-4;
- § 15, упр. 9 (г, д, е), 10 (а, б, в, г);
- § 16, упр. 3-6:
- Готовиться к контрольной работе!
IV. Рефлексия. (слайд презентации)
Ребята, что вас понравилось сегодня на уроке?
V. Итоги урока. Оценки за урок.