Учебник: Рудзитис Г.Е, Фельдман Ф.Г. Химия: учебник для 9 класса общеобразовательных учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – 12-е изд. – М.: Просвещение, ОАО “Московские учебники”, 2009. – 191 с
Цель: сформировать представление учащихся о окислительно-восстановительных процессах, их механизме
Ожидаемые результаты
Предметные:
В ходе работы учащиеся
приобретут
- способность анализировать и объективно оценивать жизненные ситуации, связанные с химией, навыками безопасного обращения с веществами, используемыми в повседневной жизни; умением анализировать и планировать экологически безопасное поведение в целях сохранения здоровья и окружающей среды
- умение устанавливать связи между реально наблюдаемыми химическими явлениями и процессами, объяснять причины многообразия веществ, зависимость свойств веществ от их строения;
овладеют научным подходом к составлению уравнению окислительно-восстановительных реакций
Метапредметные
В ходе работы учащиеся смогут
- определять понятия, создавать обобщения, устанавливать аналогии, классифицировать, самостоятельно выбирать основания и критерии для классификации, устанавливать причинно-следственные связи, строить логическое рассуждение, умозаключение (индуктивное, дедуктивное и по аналогии) и делать выводы;
- создавать, применять и преобразовывать знаки и символы, модели и схемы для решения учебных и познавательных задач;
- применять экологическое мышление в познавательной, коммуникативной, социальной практике и профессиональной ориентации
Личностные
В ходе работы учащиеся приобретут
- основы экологической культуры соответствующей современному уровню экологического мышления, опыт экологически ориентированной рефлексивно-оценочной и практической деятельности в жизненных ситуациях;
Элементы содержания, проверяемые заданиями КИМ ОГЭ
2.1. Химическая реакция. Условия и признаки протекания химических реакций. Химические уравнения.
2.2. Классификация химических реакций по изменению степеней окисления химических элементов
2.6. Окислительно-восстановительные реакции. Окислитель и восстановитель.
Умения и виды деятельности, проверяемые КИМ ГИА
Знать/понимать
- химическую символику: формулы химических веществ, уравнения химических реакций
- важнейшие химические понятия:, степень окисления, окислитель и восстановитель, окисление и восстановление, основные типы реакций в неорганической химии
1.2.1. характерные признаки важнейших химических понятий
1.2.2. о существовании взаимосвязи между важнейшими химическими понятиями
Уметь
Составлять
2.5.3. уравнения химических реакций.
Форма проведения: урок с использованием ИКТ, включением парных, индивидуальных форм организации учебно-познавательной деятельности учащихся.
Продолжительность учебного занятия: 45 минут.
Использование педагогических технологий: метод эвристического обучения, обучение в сотрудничестве
Ход урока
I. Проблематизация, актуализация, мотивация – 10 мин.
Фронтальная беседа
- Что такое атомы и ионы.
- Чем они отличаются?
- Что такое электроны?
- Что такое степень окисления?
- Как рассчитывается степень окисления?
На доске учащимся предлагается расставить степени окисления в следующих веществах:
Сl2O7, SO3, H3PO4, P2O5, Na2CO3, CuSO4, Cl2, HClO4, K2Cr2O7, Cr2(SO4)3, Al(NO3)3, CaSO4,
NaMnO4, MnCl2, HNO3, N2, N2O, HNO2, H2S, Ca3(PO4)2
II. Изучение нового материала. Объяснение учителя. 15 мин.
Основные понятия (слайд 2):
Окислительно-восстановительные реакции – это реакции, в которых изменяются степени окисления двух элементов, один из которых является восстановителем, а другой – окислителем
Восстановитель – это тот элемент, который в процессе реакции отдает электроны, и сам при этом окисляется
Окислитель – это тот элемент, который в процессе реакции принимает электроны, и сам при этом восстанавливается
Правила составления окислительно-восстановительных уравнений (слайд 3)
1. Запишем уравнение реакции (слайд 4).
CuS+HNO3 —>Cu(NO3)2+ S + NO+H2O
2. Расставим степени окисления всех элементов
Cu+2S-2 +H+1N+5O-23 —> Cu+2(N+5O-23)-12+ S0 + N+2O-2+H+12O-2
3. Выделим элементы, которые поменяли степени окисления
Cu+2S-2 +H+1N+5O-23 —> Cu+2(N+5O-23)-12+ S0 + N+2O-2+H+12O-2
Видим, что в результате реакции поменяли степени окисления два элемента –
- сера (S) поменяла полностью (от – 2 до 0)
- aзот (N) поменял частично (от +5 до +2 поменял), часть осталась +5
4. Выпишем те элементы, которые поменяли степени окисления и покажем переход электронов (слайд 5.)
CuS-2 +HN+5O3 —> Cu(N+5O3)2+ S0 + N+2O+H2O
N+5 +3e N+2
S-2 - 2e S0
5. Составим электронный баланс, найдем коэффициенты
| Переход е– | Число переданных элементом электронов | Наименьшее общее кратное между числом переданных электронов | Коэффициенты (находятся делением наименьшего общего кратного на число переданных электронов) |
| 3 | 6 | 2 | |
| 2 | 3 |
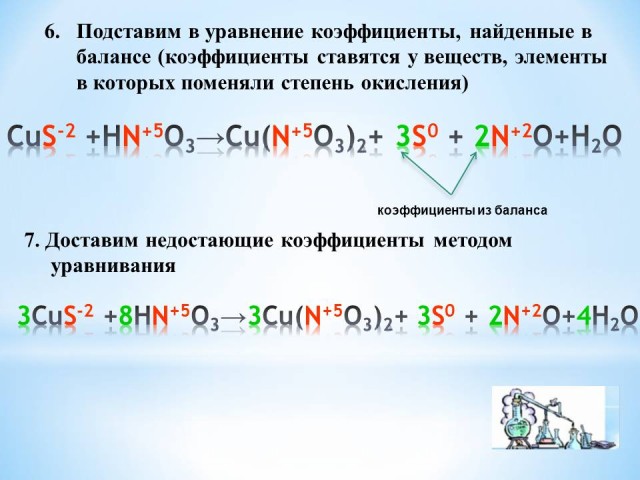
6. Подставим в уравнение коэффициенты, найденные в балансе (коэффициенты ставятся у веществ, элементы в которых поменяли степень окисления) (слайд 6).
CuS-2 +HN+5O3 —> Cu(N+5O3)2+ 3S0 + 2N+2O+H2O
7. Доставим недостающие коэффициенты методом уравнивания
3CuS-2 +8HN+5O3 —> 3Cu(N+5O3)2+ 3S0 + 2N+2O+4H2O
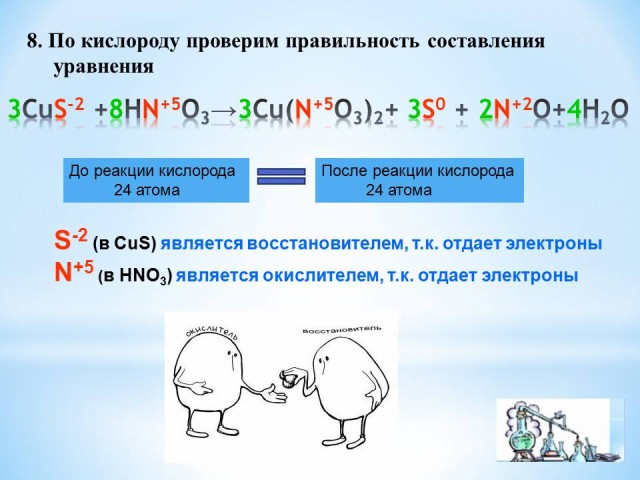
8. По кислороду проверим правильность составления уравнения (слайд 7).
До реакции кислорода 24 атома = После реакции кислорода 24 атома
9. Выдели окислитель и восстановитель и процессы – окисления и восстановления
S-2 (в CuS) является восстановителем, т.к. отдает электроны
N+5 (в HNO3) является окислителем, т.к. отдает электроны
III. Закрепление изученного материала (25 мин)
Учащимся предлагается выполнить задание в парах.
Задание 1. 10 мин. (слайд 8)
Учащимся предлагается составить уравнение реакции в соответствии с алгоритмом.
Mg+H2SO4 —> MgSO4+ H2S + H2O
Проверка задания
4Mg0+5H2+1 S+6O4-2 —> 4Mg+2S+6O4-2+ H2+1S-2 + 4H2+1O-2
| Переход е – | Число электронов | НОК | Коэффициенты |
| 2 | 8 |
4 | |
| 8 |
1 |
Задание 2. 15 мин. (слайды 9, 10)
Учащимся предлагается выполнить тест (в парах). Задания теста проверяются и разбираются на доске.
Вопрос № 1
Какое уравнение соответствует окислительно-восстановительной реакции?
- CaCO3= CaO + CO2
- BaCl2 + Na2SO4 = BaSO4 + 2NaCl
- Zn + H2SO4 = ZnSO4 + H2
- Na2CO3 + CO2 + H2O = 2NaHCO3
Вопрос № 2
В уравнении реакции 2Al + 3Br2=2AlBr3 коэффициент перед формулой восстановителя равен
- 2
- 3
- 1
- 4
Вопрос № 3
В уравнении реакции 5Сa + 12HNO3 = 5Ca(NO3)2 + N2 + 6H2O окислителем является
- Ca
- Ca(NO3)2
- HNO3
- H2O
Вопрос № 4
Какая из предложенных схем будет соответствовать восстановителю
- S0 > S-2
- S+4 —> S+6
- S-2 > S-2
- S+6 —> S+4
Вопрос № 5
В уравнении реакции 2SO2 + O2 —> 2 SO3 сера
- окисляется
- восстанавливается
- ни окисляется, ни восстанавливается
- и окисляется, и восстанавливается
Вопрос № 6
Какой элемент является восстановителем в уравнении реакции
2KClO3 —> 2KCl + 3O2
- калий
- хлор
- кислород
- водород
Вопрос № 7
Схема Br-1 —> Br+5 соответствует элементу
- окислителю
- восстановителю
- и окислителю, и восстановителю
Вопрос № 8
Соляная кислота является восстановителем в реакции
- PbO2 + 4HCl = PbCl2 + Cl2 + 2H2O
- Zn + 2HCl = ZnCl2 + H2
- PbО + 2HCl = PbCl2 + H2О
- Na2CO3 + 2HCl = 2NaCl+ CO2 + H2O
Ответы на вопросы теста.
номер вопроса 1 2 3 4 5 6 7 8 ответ 3 1 3 2 1 3 2 1
Домашнее задание: параграф 5 упр. 6,7,8 стр. 22 (учебник).