Класс: 8
Базовый учебник: О.С. Габриелян, Химия. 8 класс. Дрофа 2013 г.
План-конспект урока
Цель: знакомство учащихся со степенями окисления химических элементов в бинарных соединениях.
Задачи:
1. Повторение видов химических связей;
2. Определение существования зарядов химических элементов в соединениях, их особенностей;
3. Формирование навыков определения степени окисления химических элементов в бинарных соединений и написания их названий;
4. Воспитание коммуникативности, развитие навыков работы в группах.
Тип урока: урок усвоения новых навыков и умений.
Формы работы учащихся: индивидуальная, групповая.
Используемые технологии - ИКТ, проблемно-диалоговое обучение, здоровьесбережение. Активные формы обучения - практическая работа, разминка.
Необходимое техническое оборудование - мультимедийная установка, диски CD, мяч для разминки.
Таблица 1. Структура и ход урока
| Этап урока | Деятельность учителя | Деятельность обучающихся | Время (в мин.) |
| Организационный момент Проверка готовности к уроку, эмоциональный настрой на урок |
Приветствует учащихся, просит их проверить готовность к уроку | Приветствуют учителя, осуществляют самопроверку готовности к уроку | 2 |
| Актуализация опорных знаний урока. Проверка опорных знаний учащихся, необходимых для изучения нового материала. |
В начале урока я вас попросила достать
наши карточки с химическими элементами. Найдите
и положите перед собой четыре химических
элемента — Натрий, хлор, водород и магний. Чтобы
нам определить тему нашего урока и определить
его цель, нам нужно будет выполнить задание и
вспомнить все, что мы с вами уже знаем про
химические соединения. (Презентация.ppt - Слайд 4).
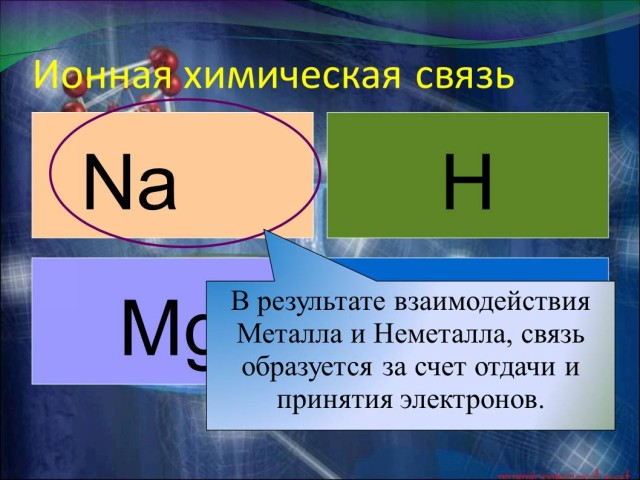
Работать будем по парам, Из 4 химических
элементов составить 4 химических соединения с
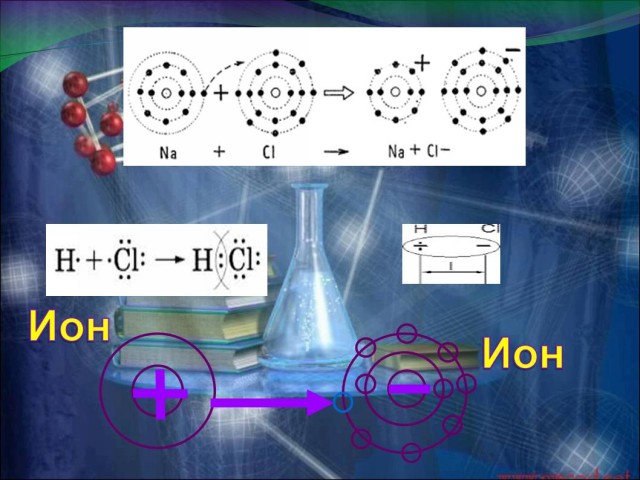
разными химическими связями. Давайте укажем, какими химическими связями обладают простые вещества Mg и H2. (Презентация.ppt - Слайд 5 и 6). А теперь рассмотрим схемы образования сложных веществ NaCl, HСl. (У доски работают два человека.) Итак делаем вывод: в первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился в ион с зарядом +1, а атом хлора принял электрон и превратился в ион с зарядом -1. (Презентация.ppt - Слайд 10). В молекуле же HCl связь образуется за счет спаривания неспаренных внешних электронов и образования общей электронной пары атомов водорода и хлора. (Презентация.ppt - Слайд 10). Но так как атом хлора более электроотрицателен, то он притягивает общую электронную пару к себе, и за счет этого атом водорода заряжается положительно, а атом хлора отрицательно частично. (Презентация.ppt - Слайд 10). Условный заряд атомов химических элементов в соединениях называют степенью окисления. Показываю на “Конструкторе молекул”, как выглядит молекулы этих веществ в пространстве. |
Выслушивают задание, делятся на пары,
обсуждают, выполняют задание.
Предлагают варианты соединений с разными химическими связями: Mg, H2, NaCl, HСl. Говорят о химических связях простых веществ и объясняют образование связи в веществах. |
10 |
| Мотивация к изучению нового
материала Обеспечение мотивации и принятия цели учебно-познавательной деятельности |
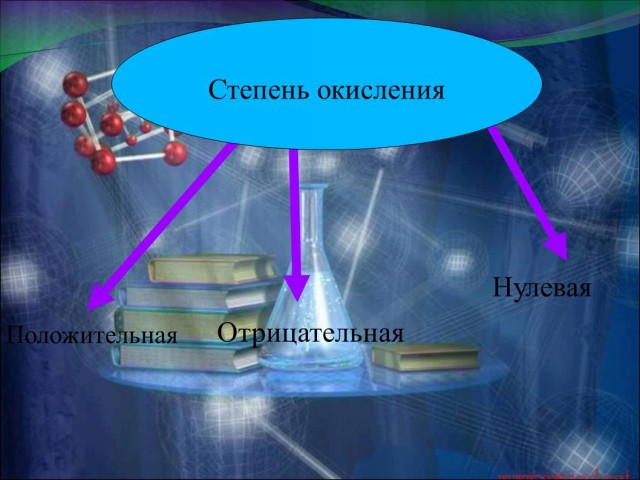
Специальными знаками на приведенных учащимся формулах показываю условный заряд-степень окисления химических элементов Таким образом логическими выводами подвожу учащихся к формулированию темы и цели урока: только ли эти химические соединения обладают условным зарядом? Как определить степень окисления у других химических элементов? Существуют ли правила определения степени окисления? Можно ли составлять химические формулы и называть химические соединения? | Высказывают свои мнения, формулируют предположения по определению темы и цели урока. | 3 |
| Усвоение новых знаний и способов
действий Обеспечение восприятия, осмысления и первичного запоминания знаний. |
Записываем тему в тетрадь и фиксируем
на доске. В учебнике (О.С. Габриелян, Химия. 8 класс.
Дрофа 2013г.) на стр. 103 есть определение степени
окисления, прочитаем и запишем это определение в
своих тетрадях. Подчеркните у себя в тетрадях,
что это условное обозначение. (Презентация.ppt -
Слайд 11) Разбираем, какие степени окисления бывают, записываем правила определения степени окисления (Презентация.ppt - Слайд 12,13). Физкультминутка. (Игра с мячом.) Записываю на доске примеры химических соединений: Na2O; O2; H2SO4; N2; S; H2O; Al; Cu; HNO3; F2; Ca. Объясняю способы определения степени окисления химических элементов в этих соединениях (Презентация.ppt - Слайд 13). Определение степени окисления начинаем с записи известных степеней окисления, например, H2SO4, нам известна степень окисления водорода +1 и степень окисления кислорода -2, неизвестна степень окисления серы, обозначим ее за “х”, решаем уравнение +1Х2 +Х + (-2Х4) = 0; Х = +6, следовательно, степень окисления элементов в формуле серной кислоты равна H2+1S+6O4-2.( Презентация.ppt - Слайд 16) Разбираю на доске два примера на определение степени окисления у веществ: BaSO4; Zn; H2CO3. Знать степень окисления элементов необходимо и для того, чтобы правильно называть химические соединения. (фрагмент видео с учебного диска) Название бинарных соединений состоят из двух слов – названий образующих их химических элементов. Первое слово обозначает электроотрицательную часть соединения – неметалл, его латинское название с суффиксом –ид стоит всегда в именительном падеже. Второе слово обозначает электроположительную часть – металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже. (Презентация.ppt - Слайд 17) |
По мере изучения делают записи в тетрадях. Воспринимают информацию, сообщаемую учителем. Работают с материалами ЭОР, учебником. Фиксируют новые термины и понятия в тетрадях. Слушают мнения одноклассников. Формулируют выводы | 20 |
| Первичное закрепление изученного
материала Освоение способа действия с полученными знаниями в практической деятельности. |
Даю задание определение степени
окисления у химических элементов в химических
соединениях (карточки); Через 3 минуты выясняю степень выполненного задания и вместе определяем причины затруднения при выполнении задания; Еще раз повторяем правила определения степени окисления химических элементов; Проверяем по шаблону, исправляем ошибки. |
Выполняют задание письменно; Проверяют, анализируют, ищут причину затруднения; Проверяют по шаблону, исправляют ошибки. |
5 |
| Рефлексия учебной деятельности | Еще раз вспоминаем все правила определения степени окисления в форме беседы. | Отвечают на вопросы по цепочке. | 3 |
| Подведение итогов Выявление качества и уровня овладения знаниями.. |
Оцениваю работу учащихся, комментирую оценки. Комментирую д-з:, параг. 18, стр. 106 № 1,2,5. О.С. Габриелян, Химия. 8 класс. Дрофа 2013г. | Слушают, оценивают себя и других. Записывают домашнее задание. | 2 |
Таблица 2. ПЕРЕЧЕНЬ ЭОР, ИСПОЛЬЗУЕМЫХ НА ДАННОМ УРОКЕ
| Название ресурса | Тип, вид ресурса | Форма предъявления информации (иллюстрация, презентация, видеофрагменты, тест, модель и т.д.) |
| “Степень окисление неорганических соединений” | Файл | Презентация Microsoft Office Point - Презентация.ppt |
| Конструктор молекул | Виртуальная химическая лаборатория 8 класс | CD диск (фирма “Новый диск”) |
| Химия. Базовый курс 8-9 класс | 1С Образовательная коллекция | CD диск |