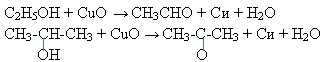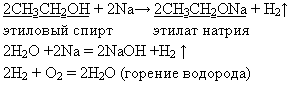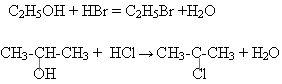Задачи урока:
- Познавательные: исследовательским способом доказать губительное влияние алкоголя на белки живых организмов, расширить знания учащихся о причинах и последствиях негативного влияния алкоголя на организм человека.
- Развивающие: продолжить развитие общеучебных умений при выполнении лабораторной работы; анализ информации, её обобщение, проведение эксперимента с соблюдением правил техники безопасности; умение наблюдать, делать выводы, устанавливать причинно-следственные отношения.
- Воспитательные: формировать негативное отношение к алкоголизму как общественному явлению; подвести учащихся к осознанному отказу от алкоголя, основанному на знаниях о его вредных последствиях.
Формирование ключевых компетенций:
ценностно-смысловых - видеть и
понимать окружающий мир с позиции химии,
выбирать целевые и смысловые установки для своих
действий и поступков, вести здоровый образ жизни
Тип урока: интегрированный урок-исследование при изучении нового материала по технологии развивающего обучения
Методы:
- обучения – диалогический
- преподавания – иллюстративно-стимулирующий
- учения – частично-поисковый, экспериментальный
Оборудование:
- мультимедийный проектор с экраном
- презентация к уроку (Презентация)
- компьютер
Для обучающихся (на каждый стол или на группу):
- инструктивная карта по проведению урока химии (Приложение 2); 6 пробирок; спиртовка; спиртсодержащие медицинские препараты, средства бытовой химии, фильтровальные бумаги, пипетки, раствор этилового спирта; вода; раствор яичного белка; растительное масло; медная проволока, безводный сульфат меди (II) и цельная кровь.
На демонстрационном столе: пробирки, стакан с водой, металлический натрий, пинцет, нож, фильтровальная бумага, пробка с трубкой, спички, раствор фенолфталеина, фарфоровые чашки (З).
Ход урока
Организационный.
I. Ориентировочно-мотивационный этап.
Задание1. Ориентация
а) взаимопроверка выполнения домашнего задания.(тесты) (слайд 3,4) приложение 1
б) выяснения предмета познания.
Вопросы: (слайд 1)
Учитель. Какой раздел химии начали изучать? (кислородсодержащие соединения). Какие классы соединений к ним относится?( спирты, фенолы, альдегиды, карбоновые кислоты, сложные эфиры, углеводы). Какой класс соединений изучаем? (спирты)
Учитель. По какому плану изучили спирты? (сначала написали гомологический ряд спиртов, затем вывели общую формулу, далее изучили классификацию, номенклатуру и изомерию спиртов)
Учитель. Перечислите признаки классификации спиртов (по строению углеводородного радикала и по числу гидроксильных групп)
Учитель. Каким способом мы вывели определение понятия “спирты”? (анализировали состав нескольких видов представителей гомологического ряда спиртов, находили их общие существенные признаки, и на основе этих существенных признаков сформулировали определение. Для этого особо выделили словосочетание - функциональная группа)
Далее учитель организует взаимопроверку и взаимооцнеку домашнего задания. У доски работает 1 ученик - выводит общую формулу спиртов на основе гомологического ряда. Дает определение (Спирты - это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на функциональную группу -гидроксогруппами).
Общие молекулярные формулы спиртов : R-OH, CnH2n+1OH, CnH2n+2O
| Название спиртов | Формула |
| Метиловый (метанол) | СН3ОН |
| Этиловый (этанол) | С2Н5ОН |
| Пропиловый (пропанол-1) | С3Н7ОН |
| Бутиловый (бутанол-1) | С4Н9ОН |
| Аллиловый (пентанол-1) | С5Н11ОН |
Учитель. Итак, любой спирт состоит из двух групп атомов - углеводородного радикала и функциональной группы - ОН. Но какая из этих двух групп атомов наиболее существенная? Пока нам неизвестно. Выяснением этого вопроса мы и будем заниматься на уроке.
Задание 1.2. Мотивация.
Учитель. Нужны ли нам знания о функциональной группе спиртов? (Нужны, в нашем организме вырабатываются спирты. Спирты входят в состав природных и синтетических соединений. Не зная их, мы не можем ориентироваться в этом мире.)
Учитель. Тему нашего сегодняшнего урока нам подскажут предметы, которые вы видите на демонстрационном столе. Среди них медицинские препараты, средства бытовой химии, косметические средства. Как вы думаете, что их объединяет? (слайд 5)
Предполагаемые ответы учащихся: наличие спирта в составе предложенных парфюмерных и косметических средств, медицинских препаратов, средств бытовой химии. Нам предложены вещества и материалы, для получения которых можно использовать спирты.
Учитель. Верно, следовательно, какова тема нашего урока? (Этиловый спирт и его влияние на организм человека), (слайд 1)
Задание 1.3..Целеполагание
Учитель. Каким способом мы сможем выяснить, какая часть спирта наиболее существенная? (Принцип активности.). Будем мысленно удалять, и добавлять соответствующие группы атомов.
Задание 1.4. Планирование. Задачи урока (слайд 6)
Учитель. Какой спирт является объектом исследования? (Объектом исследования является этиловый спирт).
Учитель. Какие гипотезы исследования вы предложите? (Почему у людей, употребляющих спиртные напитки, голова болит? Почему люди, употребляющие спиртные напитки, много воды пьют? Если этанол яд, то почему люди из него готовят лекарства и пьют его? и т.д.)
Учитель. По какому плану будем изучать?
- Физические свойства(растворение, испарение, температура кипения)
- Химические свойства (опыты)
- Влияние спирта на организм человека (сообщение ученика)
Учитель. Каковы задачи урока?
Ученик.
1. Исследовать физические и химические свойства этанола
2. Доказать губительное действие этанола на организм человека
3. Добывать знания на основе наблюдений, анализа и обобщения результатов эксперимента;
II. Операционально - исполнительский этап.
Задание 2.1. (первый пункт плана)
Учитель. У Вас на столах лежат инструктивные карты, в которых вы сегодня будете работать, и, конечно же, ваша работа будет оценена. Поэтому сейчас запишите свою фамилию, укажите класс (учащиеся заполняют шапку инструктивной карты). Приложение 2.
Учитель. А какие ассоциации возникают у вас со словом “спирт”? Вспомните положительную и отрицательную роль спиртов. Как правило, в отрицательной роли спиртов учащиеся указывают заболевание алкоголизм и связанное с ним асоциальное поведение людей. На экране проецируется таблица о роли спиртов в жизни человека и слова знаменитого алхимика и врача Парацельса: (слайд 7)
“Всё есть яд,
Всё есть лекарство,
Всё дело в дозе”
Учитель. Учитель приводит статистические данные об употреблении спиртных напитков.
1. Число больных алкоголизмом в нашей стране около 7 миллионов.
2. В России смертность от алкоголизма среди мужчин увеличилась в 2,5 раза, среди женщин - в 3 раза.
3. В России мужчины живут на 18 лет меньше, чем в США, и на 12 лет меньше, чем в Европе.
Учитель. С чем это связано? (Это связано с количеством потребляемого алкоголя на душу населения)
Учитель. Чтобы вещество не стало ядом, человек должен знать о нем все и умело его использовать. Поэтому сегодня главной нашей задачей на уроке изучить свойства этанола и его влияние на здоровье человека.
Учитель. Какие свойства этанола изучим вначале? (мы начнем изучение с физических свойств)
Учитель. Физические свойства этанола мы исследуем путем проведения лабораторных опытов. Свои наблюдения и выводы вы будете вписывать в инструктивную карту. Проводится инструктаж по технике безопасносности (слайд 8)
1. Вещества для проведения опытов необходимо брать в таком количестве как это указано в инструкции.
2. 3ажигать спиртовку только спичкой, не наклонять спиртовку к другой горящей спиртовке.
3. Нагреваемый предмет помещать в верхней трети пламени.
4. Чтобы погасить пламя спиртовки, её следует закрыть колпачком.
Опыт. Растворимость этилового спирта в воде. (слайд 9)
Цель: изучить физические свойства этилового спирта.
Ход опыта: В пробирку прилить 1мл воды и столько же спирта. Учащиеся проводят опыт по изучению растворимости изоамилового спирта в воде. Для изучения испари-мости на 2 фильтровальные бумаги наносят пипеткой воду и этанол.
Учитель. Почему спирт растворяется в воде? (этиловый спирт жадно поглощает воду и образует с ним водородные связи). Анализ таблицы №1 “Образование водородной связи. Учитель в совместной деятельности изучают механизм образования водородных связей.
Учитель. Почему капелька спирта испаряется быстрее, чем вода? Учащимся необходимо держать смоченные фильтры в руках, чтобы испарение шло быстрее с обеих сторон. (водородных связей в капельке воды больше, чем в спирте). Анализ таблицы №1 “Образование водородных связей”.
Учитель. Почему изоамиловый спирт плохо растворяется в воде? (Большая молекулярная масса радикала-изоамила по сравнению функциональной группы, связи в радикале слабополярные и поэтому не растворяется в воде). Ученик выводит формулу изоамилового спирта на доске и обводит в круг цветным мелом радикал и учащиеся убеждаются в том , что масса радикала больше, чем массы ОН. Далее учитель предлагает найти по учебнику ответ на вопрос “Высшие спирты растворяются в воде?” (нет, твердые спирты практически не растворимы в воде)
Учитель. Почему среди спиртов нет газообразных соединений? (Из-за водородных связей молекулы спиртов ассоциируются, поэтому среди спиртов нет газов, низшие спирты - жидкости, высшие - твёрдые вещества).
Учитель. Почему температура кипения спиртов больше, чем у соответствующих им предельных углеводородов? (наличие водородных связей, для разрыва которых потребуется дополнительное количество энергии).
Учитель. Таким образом, если мысленно отнять от молекулы этилового спирта функциональную группу ОН, то оставшаяся радикал -метил не растворится в воде. Радикал метил, как и метан придает свойства нерастворимости в воде. Какая характерная реакция для метана как алкана? (реакция замещения). Следовательно, радикал спирта вступает в реакции замещения с галогенами:
Опыт. Этиловый спирт растворитель жиров, (слайд 10)
Цель: выяснить, растворяет ли этанол жиры.
Ход опыта: В 1 пробирку налить 1 мл воды, во вторую пробирку - 1 мл этанола, в каждую добавить 1-2 капли растительного жира. Пробирки встряхнуть.
Ребята делают вывод о растворимости спирта. Данные записывают в таблицу №1
| Спирт | Агрегатное состояние | Цвет | Запах | Растворимость в воде | Растворимость в жирах |
| этанол | Жидкие | бесцветен | характерным запахом | смешиваются с водой в любых соотношениях | Растворяют жиры |
| бутанол |
Вывод: спирт хорошо растворим в жирах, скорость прохождения молекул спирта больше скорости прохождения воды. Следовательно, всасывается этиловый спирт в жирах быстрее.
Учитель. Молекула спирта подходит к молекуле жира, взаимодействует с ней и вышибает оболочку клетки. Клетка повреждена. Именно в результате этого алкогольного повреждения клетки, внутрь её может попасть всё, что угодно. Через поврежденную мембрану проходит этанол и доходит до ядра и хромосом половых клеток. В конечном счете, алкоголь данную клетку может убить совсем. Повреждаются эпителиальные клетки нефрона почек. В результате она будет пропускать белковые молекулы и в моче обнаружится белок.
Учитель. Алкоголь ядовит: 6-8 г алкоголя на 1 кг массы взрослого человека являются смертельной дозой. А какая для вас смертельная доза спирта? Доза спирта может изменяться в зависимости от чувствительности к этиловому спирту, условий его приема (крепость напитков, наполненность желудка пищей) и т. д. У одних лиц смерть может наступить после приема 100— 150 г чистого этилового спирта, в то время как у других лиц, смерть не наступает и после приема 600—800 г этого вещества. Для ребенка смертелен стакан водки (1,5-2 г на 1 кг массы тела).
Проникая в организм, спирт жадно поглощает воду из тканей, отрицательно влияет на слизистую оболочку желудка и кишечника, на почечный и печеночный эпителии, вызывая их раздражение, воспаление. По этой причине люди употребляющие спирт в большом количестве, вынуждены пить много воды. Алкоголь приводит также к язвенной болезни и расширению желудка, (слайд 11,12)
Следующий опыт нам поможет узнать о влиянии спирта на молекулы белков.
Опыт. “Влияние этанола на молекулы белков”. (слайд 13)
Цель: выяснить, как влияет алкоголь на структуру и свойства белка.
Ход опыта: в две пробирки налить по 1 мл яичного белка. В одну пробирку добавить 3 мл воды, а в другую столько же спирта 80-90 %. В третью пробирку с цельной кровью быка налейте 3 мл того же спирта.
Наблюдение и вывод: (в первой пробирке белок растворяется, так как он является легкорастворимым белком и хорошо усваивается организмом. Во второй пробирке образуется плотный белый осадок - в спирте белки не растворяются, спирт отнимает у белков воду. В результате этого нарушаются структура и свойства белка, его функции. В третьей пробирке кровь постепенно обесцвечивается, происходит разрушение белка гемоглобина).
Учитель. Что же происходит с клетками организма, когда поступает алкоголь высокой концентрации? (Белки клетки начинают разрушаться, что ведёт к нарушению работы всех клеток органов. (Наблюдение и вывод учащиеся записывают самостоятельно))
Учитель. Как называется процесс нарушения природной структуры белка? (денатурация)
Учитель. Почему яичный белок-альбумин стал белым по цвету? (спирт отнял воду от белка и превратился в нерастворимый белок в виде белого осадка)
Учитель. Таким образом, гипотеза, предложенная вами экспериментально, подтвердилась.
Живой организм состоит из белков, поэтому мы можем сделать следующие выводы (слайд 14)
а) влияние спирта на мембраны клеток вызывает разрушение;
б) воздействие спирта на ферменты вызывает разрушение;
в) соприкосновение спирта с эритроцитами вызывает свертывание кровяных клеток;
г) спирт обладает дезинфицирующим свойством.
Выступление ученика. Нет в человеческом организме ни одного органа, который бы не разрушался алкоголем. Но самые сильные изменения и в самую первую очередь наступают в человеческом головном мозге. Именно там этот яд имеет свойство накапливаться. После приёма кружки пива, стакана вина, 100 граммов водки — содержащийся в них спирт всасывается в кровь, с кровотоком идёт в мозг и у человека начинается процесс интенсивного разрушения коры головного мозга.
Учитель. Ответьте на вопрос, почему “слегка” перебравшие алкоголь на следующее утро ничего не помнят? (в первую очередь гибнут клетки головного мозга, отвечающие за память, происходит необратимая гибель нейронов в результате тромбоза и микроинсультов в коре головного мозга, это приводит к утрате части информации и к нарушениям кратковременной памяти) (слайд 15)
Физкультминутка
Задание 2.1. (второй пункт плана)
Ученик. Так как спирт легко растворяется в воде, он сразу же поглощается и разносится кровью по всему телу. Примерно 90% его временно задерживается в печени, где нарушает выделение желчи, гибнет много печеночных клеток. (слайд 16)
Ученик. Употребление более 20-40 граммов спирта в печени с помощью ферментов он превращается в уксусный альдегид, который в 30 раз токсичнее самого алкоголя. Воздействие последнего на организм - оглушающее, сопровождается рвотой, головокружением - в организме нарушается кислотно-щелочное равновесие. Проделав несложный опыт, убедимся в способности спирта превращаться в уксусный альдегид, который легко узнать по запаху: в малой концентрации у него приятный запах - запах прелых яблок. (слайд17)
Итак, приступим к выполнению (ученик заранее готовится к выполнению данного опыта по рекомендации учителя, учащимся нравится самим демонстрировать опыты)
Опыта 4. Окисление спиртов. (слайд 18)
Цель работы: доказать, что спирты окисляются до альдегида и кетона.
Оборудование и реактивы: две пробирки, этиловый спирт, изопропиловый спирт, спиртовка, медная проволока.
Ход работы. Прокалить спираль из медной проволоки в пламени спиртовки до появления черного налета (оксида меди II) и опустить в пробирку с этанолом и изопропиловым спиртом. Повторить 2-3 раза.
Вывод: Происходит восстановление меди и окисление спирта до уксусного альдегида и ацетона (кетона). Первичные спирты окисляются до альдегидов, а вторичные-до кетонов.
Ученик. Метаболит спирта - альдегид вызывает повреждение печени, цирроз. Врачи доказали, что возникновение мутаций и уродов у эмбрионов вызывает уксусный альдегид. Также вызывает головные боли (гипотеза урока). Хочу привести слова великого врача древности Авиценны: "Вино - враг алкоголика, оно же - друг умеренного. Чуть-чуть его - противоядие, в больших количествах - яд! Оно дозволено умным и запрещено неуравновешенным". Но ни умный, неуравновешенный - никто не может предсказать, когда, после какой рюмки, в какой роковой момент клетки организма включают в свои обменные процессы алкоголь и с тех пор уже не могут без него обходиться. Это зависит от возраста, массы, от пола, от индивидуальной чувствительности, от специфики работы и других факторов.
Учитель. Таким образом, наиболее существенной группой атомов в этаноле является ОН, так как именно эта функциональная группа обуславливает физические и химические свойства.
Учитель. Какие реакции можно ожидать, глядя на структурную формулу этанола? (анализ табл. № 2 “Химические свойства спиртов”).
Учитель. Каким образом доказать в какой пробирке находится разбавленный и концентрированный спирт? Пробирки не пронумерованы, а какая из них не знаем - внешне они одинаковы. Маркером пронумеруем пробирки №1 и №2. Какой реактив есть у вас и вы его не использовали? (безводный сульфат меди(II)). Насыпьте ложечкой безводного сульфата меди в пробирку с разбавленным и концентрированным раствором этанола.
Учитель. В какой пробирке раствор окрасился в синий цвет?
Ученик. В пробирке №1 произошла химическая реакция взаимодействия безводного сульфата меди с водой. В результате образуется кристаллогидрат сульфата меди:
CuSО4 + 5Н2О = CuSО4 * 5Н2О
Учитель. Какой вывод? (безводный сульфат меди отнимает воду от спирта и переводит его в концентрированный раствор).
Учитель. Каким образом экспериментально отличить разбавленный и концентрированный спирт? Учитель демонстрирует склянку со щелочным металлом натрия и стакан с водой. Показывает демонстрационный опыт “Взаимодействие натрия с водой” и одновременно опыт “Взаимодействие разбавленного и безводного этанола с натрием”.
Учитель. В какой пробирке у вас безводный этанол? (в пробирке №2, ученик сливает верхний слой спирта, оставив на дне кристаллы медного купороса, передает учителю). Далее учитель пинцетом опускает гранулы одинакового объема натрия в три пробирки с водой, разбавленным и безводным спиртом. Учащиеся наблюдают за скоростью протекания реакции и за горением водорода. Записывает на доске уравнение реакции взаимодействия спирта и воды с натрием:
Опыт 5. Взаимодействие безводного этанола и воды с натрием: (слайд 19)
С разбавленным спиртом протекают обе реакции - взаимодействие натрия с водой и спиртом.
Опыт 6. Гидролиз этилата натрия: (слайд 20)
В пробирку с этилатом натрия, образованный с концентрированным спиртом учитель капает фенолфталеин. Учащиеся убеждаются в том, что индикатор не изменил окраску. Далее приливает 3 мл воды, встряхивает пробирку, и раствор окрашивается в малиновый цвет. В пробирке с раствором этилата натрия, образованный с разбавленным спиртом сразу появляется малиновое окрашивание.
Учитель. Почему раствор окрасился в малиновый цвет?
Ученик. В результате гидролиза образуется щелочь по уравнению реакции:
СН3СН2ONa + Н2О —> СН3СН2ОН + NaOH
Учитель. Гидролиз необратим, так как спирты проявляют очень слабые кислотные свойства.
Учитель. Взаимодействуют ли спирты со щелочами? Для этого нальем в пробирку раствор щелочи и капнем фенолфталеин. Раствор окрасится в малиновый цвет. Теперь прильем этиловый спирт. Результат- малиновая окраска не изменится. Следовательно, спирты со щелочами не взаимодействуют.
СН3СН2ОН + NaOH - нет реакции
Учитель. Каким образом экспериментально отличить разбавленный и концентрованный спирт?. (Концентрированный этиловый спирт (60-96%) отличается от разбавленного тем, что концентрированные спирты горят).
Учитель демонстрирует видеофильм или показывает опыт горение этанола, бутанола и изоамилового спирта в фарфоровой чашке. Какой цвет пламени? (учащиеся отмечают цвет пламени, коптящее пламя изоамилового спирта и записывают уравнение реакции горения этанола).
С2Н5ОН + 3O2 —>2СO2 +ЗН2O+ Q
Учитель. Какие гипотезы исследования подтвердились экспериментально? (Учащиеся вспоминают гипотезы, предложенные в начале урока)
Взаимодействие этилового и изопропилового спирта с хлороводородом или бромоводородом. Учитель демонстрирует видео-опыт или демонстрирует опыт. (слайд 21)
III. Закрепление. (слайд 22-25) приложение 3
IV. Рефлексивно-оценочный этап. Продолжите фразу: Теперь я умею... Я уже не сделаю ошибку в... (слайд 26)
V. Домашнее задание. Реферат "Механизм влияния спиртов на организм человека". Найти информацию о применении и значении спирта в жизни человека. (слайд 27)
VI. Выход на тему следующего урока.
Мы знаем способ изучения составных частей спирта - радикала и функциональной группы. Оказалось, что наиболее существенной в формуле спирта является функциональная группа ОН - обуславливает физические и химические свойства спиртов. Если в углеводородный радикал добавить несколько гидроксогрупп, то изменится физические и химические свойства многоатомных спиртов? Этого мы не знаем. Выяснением данных вопросов займемся на следующем уроке. Следовательно, какая будет тема следующего урока? (физические и химические свойства многоатомных спиртов)
Литература:
- www.alkogoliki.com.ua
- www.urok.1sept.ru
- www.schools.mari-ei.ru
- www.xumuk.ru/encyklopedia
- Артамонова И.Г., Сагайдачная В.В. Практические работы с исследованием лекарственных препаратов и средств бытовой химии. //Химия в школе. – 2002. - №9. – С.73 – 76.
- Ветров Н.И. Если бы я знал закон. – М., 1986.
- Габриелян О.С., Остроумов И.Г. Настольная книга учителя. Химия, 10 класс. – М.: Дрофа, 2004. – 479 с.
- Зверев И.Д. Книга для чтения по анатомии, физиологии и гигиене человека. – М.: Просвещение, 1983. – 215 с.
- Игнатьева С.Ю. Профилактика алкоголизма: интегрированный урок в 10 классе. //Химия в школе. – 2003. - №1. – С.32 – 35.
- Колесов Д.В. Предупреждение вредных привычек у школьников. – М.,1984.
- Копыт Н.Я., Скворцова Е.С. Алкоголь и подростки. – М., 1984.
- Малеева В.Ф. Из опыта проведения обобщающих уроков. //Химия в школе. – 2006. - №1. – С.25 – 30.