Химические процессы, как правило, сопровождаются тепловым эффектом, который характеризуется не только абсолютной величиной, но и знаком. Исторически сложились две системы отсчета: термохимическая и термодинамическая. В термохимической системе отсчета тепловой эффект экзотермической реакции принято считать положительным, поскольку процесс сопровождается выделением теплоты (экзо – внешний). Эндотермические реакции сопровождаются отрицательным тепловым эффектом, так как теплота поглощается системой (эндо – внутренний). В термодинамике принята обратная система знаков: теплота, поглощенная системой, считается положительной; теплоте, отданной системой, присваивается знак минус. В термодинамической системе знаков тепловой эффект реакции отождествляется с изменением энтальпии системы. При записи термохимического уравнения в этой системе тепловой эффект не включается в уравнение реакции, а записывается рядом с ним.
Обобщения термохимических закономерностей дает основной закон термохимии, сформулированный в 1836 году русским ученым Г.И. Гессом. Суть этого закона заключается в том, что тепловой эффект химических реакций, протекающих при постоянном объеме или при постоянном давлении, не зависит от числа промежуточных стадий, а определяется лишь начальным и конечным состоянием системы. Закон Гесса можно проиллюстрировать схемой:
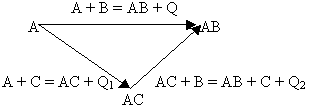
На схеме образование соединения АВ представлено двумя путями: непосредственным синтезом из веществ А и В (Q) и через стадию образования промежуточного соединения АС (Q1), которое в дальнейшем взаимодействует с веществом В (Q2) и дает тот же конечный продукт АВ. В соответствии с законом Гесса тепловой эффект прямого синтеза продукта АВ равен сумме тепловых эффектов реакций с участием промежуточного продукта АС, то есть:
Q = Q1 + Q2.
Как следует из закона Гесса, теплота образования вещества не зависит от способа его получения (первое следствие из закона Гесса). Теплота образования соединения - тепловой эффект реакции образования одного моль соединения из простых веществ в стандартном состоянии при заданных температуре и давлении. В термодинамике в качестве стандартных условий принимаются Т = 298 К; Р = 1,013.105 Па. Теплота образования соединения в этих условиях называется стандартной теплотой образования. При выполнении термохимических расчетов теплоты образования простых веществ в стандартном состоянии условно принимаются равными нулю. Приведу примеры классического варианта выполнения термохимического расчета и оформления решения задачи.
Пример № 1. Реакция горения аммиака выражается уравнением:
4NH3(г.)+ 3O2(г.)= 2N2(г.)+ 6Н2О (ж.)+ 1530,28 кДж
Вычислите теплоту образования аммиака ( г.), если известно, что теплота образования воды (ж.) составляет + 285,84 кДж/моль.
Решение. Прежде всего представим данное химическое взаимодействие, как совокупность промежуточных стадий с учетом стехиометрических коэффициентов в уравнении реакции.
1. Разложение аммиака на простые вещества азот и водород с учетом того, что в реакции горения участвует 4 моль аммиака.
4 NH3 = 2 N2 + 6 H2 + Q1 (кДж)
2. Образование воды (ж.) из простых веществ: водорода и кислорода с учетом того, что в результате реакции горения образуется 6 моль воды. В связи с этим фактом значение теплоты образования воды (ж.) умножим на 6 моль
6 Н2 + 3 О2 = 6 Н2О(ж.) + 6 моль. 285,84 (кДж/моль)
Учитывая то, что теплоты образования простых веществ условно приняты равными нулю и, воспользовавшись законом Гесса, получим уравнение:
1530,28 (кДж) = Q1 (кДж) + 6 моль. 285,84 (кДж/моль)
Откуда следует, что Q1 = - 184,76 (кДж). Найденное значение Q1- тепловой эффект реакции разложения 4 моль аммиака. Значит, разложение одного моль аммиака будет сопровождаться тепловым эффектом, равным значению -184,76 (кДж)/4 моль = -46,19 (кДж/моль). Образование аммиака – процесс, противоположный разложению. Поэтому теплота образования аммиака будет иметь противоположный знак плюс. Ответ: теплота образования аммиака (г.) равна + 46,19 (кДж/моль).
Эту задачу можно было решить, воспользовавшись вторым следствием из закона Гесса: стандартный тепловой эффект реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ с учетом стехиометрических коэффициентов в уравнении реакции. Так как теплоты образования простых веществ, в частности кислорода и азота, приняты равными нулю, получим уравнение:
+ 1530,28 (кДж) = 6 моль. 285,84 (кДж/моль) – 4 моль.Q (кДж/моль), где Q – стандартная теплота образования аммиака (г.). Таким образом, найдено то же самое значение: + 46,19 (кДж/моль).
Пример № 2. Реакция горения этана выражается уравнением:
С2Н6 (г.) + 3,5 О2 (г.) = 2 СО2 (г.) + 3 Н2О (ж.) + Q
Вычислите тепловой эффект этой реакции Q, если теплоты образования углекислого газа (г.), волы (ж.) и этана (г.) равны +393,51 (кДж/моль); + 285,84 (кДж/моль); + 84,67 (кДж/моль) соответственно.
Решение. Представим процесс горения этана, как совокупность промежуточных стадий с учетом стехиометрических коэффициентов в уравнении реакции:
2 С+ 2 О2 = 2 СО2 (г.) + 2 моль. ( +393,51) (кДж/моль)
3 Н2 + 1,5 О2 = 3 Н2О (ж.) + 3 моль.(+285,84) (кДж/моль)
С2Н6 (г.) = 2 С+ 3 Н2 + 1 моль.(- 84,67) (кДж/моль)
Воспользовавшись законом Гесса, получим математическое уравнение для вычисления теплового эффекта реакции горения этана: Q (кДж.) = 2 моль. (+393,51) (кДж/моль) + 3 моль. (+285,84) (кДж/моль) + 1 моль. ( -84,67) (кДж/моль). Ответ: Q = + 1559,87 кДж.
Для выполнения заданий, требующих термохимических расчетов, так же удобно воспользоваться графическим вариантом оформления решения на основе системы векторов, в которой каждый из них будет иллюстрировать одну из промежуточных стадий описываемого в задании химического взаимодействия. Таким образом, совокупность векторов будет эквивалентна всей последовательности промежуточных взаимодействий, приводящих систему из начального состояния в конечное. Графический способ оформления решения задачи отличается значительно большей наглядностью и, как следствие, сам ход решения становится более доступным для понимания обучающихся.
Пример № 1. При стандартных условиях теплота сгорания водорода в кислороде равна 286,2 кДж/моль, а теплота сгорания водорода в озоне равна 333,9 кДж/моль. Чему равна теплота образования озона из кислорода при стандартных условиях?
С целью решения задачи, представим ее условие графически, воспользовавшись системой векторов:
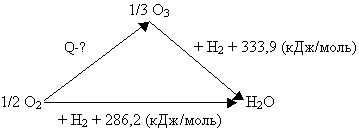
Сложение векторов даст следующее уравнение: Q + 333,9 (кДж/моль) = 286,2 (кДж/моль), откуда Q = - 47,7 кДж/моль. Найденное значение Q необходимо умножить на три, так как расчет выполнен с учетом образования 1/3 молекулы озона. Таким образом, 3.(-47,7) (кДж/моль) = - 143,1 (кДж/моль).
Пример № 2. Энергии диссоциации Н2, СI2 и тепловой эффект образования HCI составляют соответственно -436, -243 и + 92 кДж/моль. Чему равна энергия диссоциации HCI?
Как и в предыдущем случае, представим данные задачи графически:
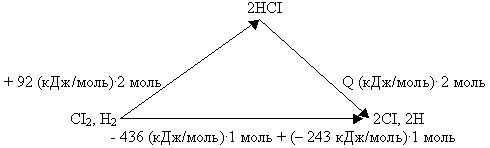
Воспользовавшись системой векторов, составим математическое уравнение:
+ 92 (кДж/моль).2моль + Q (кДж/моль).2моль = (-436 кДж/моль).1моль + (-243 кДж/моль).1 моль, откуда следует, что Q = - 431,5 кДж.
Как правило, выполнение термохимических расчетов вызывает у учащихся достаточно серьезные затруднения. Приведенный вариант графического оформления решения более нагляден и поэтому существенно облегчает понимание сути происходящих процессов и, как следствие, поиск решения задачи.