Цель: Изучить окислительные и особые свойства концентрированной серной кислоты, выявить причину этих свойств; обобщить знания учащихся об общих свойствах кислот; продолжить формировать навыки применения знаний в нестандартных и жизненных ситуациях, с использованием индивидуальных и дифференцированных заданий.
Задачи:
1. Обобщить и закрепить знания учащихся о серной кислоте, изучить свойства концентрированной серной кислоты; способствовать развитию умения мыслить логически и владеть химическим языком; переходу от формального – логического восприятия материала данной темы к образно-логическому мышлению с использованием разноуровневых, посильных и нестандартных задач.
2. Развить навыки наблюдения, выявления ошибок, решения задач, умения выделять главное, сравнивать изучаемые факты, логично излагать мысли и делать выводы; учить размышлять, делать предположения, прогнозировать.
3. Содействовать формированию основных мировоззренческих идей через познавательную активность и творческую самостоятельность учащихся.
4. Воспитывать умения работать самостоятельно с применением само- и взаимоконтроля. Показать связь изучаемой темы с жизнью. Воспитывать научное мировоззрение на основе взаимосвязи свойств и строения.
Оборудование:
укладка №1: концентрированная серная кислота, лучина, пинцет, полоска бумаги.
укладка №2: концентрированная серная кислота, медь в стружке, спиртовка, спички, газоотводная трубка, р-р метилового – оранжевого , вода, металлический штатив с лапкой, штатив для пробирок, пробирка с водой .
укладка №3: концентрированная серная кислота, цинк в гранулах, газоотводная трубка, р-р метилового – оранжевого , вода, металлический штатив с лапкой, штатив для пробирок, пробирка с водой .
укладка №4: концентрированная серная кислота, алюминий в гранулах, спиртовка, спички, газоотводная трубка, р-р метилового – оранжевого , вода, металлический штатив с лапкой, штатив для пробирок, пробирка с водой .
укладка №5: концентрированная серная кислота, железо в стружке, спиртовка, спички, газоотводная трубка, р-р метилового – оранжевого , вода, металлический штатив с лапкой, штатив для пробирок, пробирка с водой .
укладка №6: концентрированная серная кислота, магний (лента), газоотводная трубка, р-р метилового – оранжевого , вода, р-р нитрата свинца, металлический штатив с лапкой, штатив для пробирок, пробирка с водой.
укладка №7: концентрированная серная кислота, пробирка с водой, высокий стеклянный стакан, стеклянная палочка, пипетка.
укладка №8: штатив с пробирками – 4 шт, пипетка, раствор серной кислоты, раствор хлорида бария, нитрата серебра, вода; раствор хлорида калия;
Ход урока
I. Организационный момент (1 мин)
Учитель: В сочинениях монаха-алхимика Василия Валентина, жившего в XV веке, которого многие историки химии считают мифической фигурой, было рекомендовано получать “дух из солей” ( “спиритус салис”) - прокаливанием смеси каменной соли и железного купороса. При этом отгонялась жидкость, которая поражала воображения алхимиков: она дымила на воздухе, вызывала кашель, разъедала ткань, бумагу, металл. О каком веществе идет речь? Какими еще интересными свойствами и почему обладает это вещество? Вот на эти вопросы нам предстоит ответить сегодня на уроке.
Девизом сегодняшнего урока можно считать слова английского философа и педагога Д.Локка:
“Лучший путь к истине, это изучать вещи, как они есть, а не верить, что они такие, как нас этому учили”.
Но прежде чем изучать новый материал, нам необходимо повторить то, что мы уже знаем о серной кислоте.
II. Опрос (8 мин)
а\ у доски:
Привести уравнения химических реакций, отражающие химические свойства серной кислоты.
б\ тестовая проверка знаний по теме “Серная кислота” с использованием компьютера ( можно и на бумажном носителе, тогда ключ правильных ответов предлагается позже) . Задания с различным уровнем сложности. Учащиеся самостоятельно выбирают себе уровень сложности. Задание выполняется с самопроверкой. <Приложение 1>
в\ практическое индивидуальное задание (укладка № 8)
Задание:
1. Прочитай текст докладной записки завхоза одного из автотранспортных предприятий:
“Разбирая реактивы на сладе, рабочие обнаружили забытую бутыль с бесцветной жидкостью. Этикетка на бутыли была повреждена, сохранилась только “Концентрированная ….рная кислота”. Кислоту можно применить для заправки аккумуляторов, но как определить, что за кислота в бутыли и годится ли она для этих целей?”
2. Предположи, какая кислота может находиться в бутыли.
3. Предложи план и способ распознавания данных кислот.
4. Проделай необходимые реакции, используя имеющиеся в наличии реактивы.
5. Определи кислоту и сделай вывод о возможности ее использования в качестве электролита для заправки аккумуляторов, ответ обоснуй.
Ученик: Кислота в бутыли может быть хлорной, серной, ортофосфорной, борной.
Борная и ортофосфорная кислоты - твердые вещества. Хлорную кислоту можно обнаружить с помощью реакции ее с хлоридом калия после ее разбавления, но эта реакция результатов не дала. Серная кислота после разбавления дает качественную реакцию с хлоридом бария. При проведении данной реакции выпал белый осадок, значит, в бутыли находилась серная кислота. Так как она является сильным электролитом, ее можно использовать для заправки аккумулятора.
г\ фронтальная работа
Ответьте на вопросы:
1.“Слово “кислота” - это функция вещества, а не этикетка с названием”, - говорил российский химик Иван Владимирович Тананаев. Что он имел в виду?
Ученик: Кислотами называются вещества способные в водном растворе отщеплять протон водорода и при этом совсем
2. Объясните понятия “сильная” и “слабая кислота”.
Ученик: Сильные кислоты в водных растворах практически полностью диссоциируют на ионы с образованием протона водорода, а слабые лишь частично. Чем больше степень диссоциации протонов водорода, тем сильнее кислота.
3. Сильной или слабой кислотой является серная кислота? Почему?
Ученик: Серная кислота является сильной кислотой. Это объясняется строением ее молекулы так как, электронная плотность от атомов водорода смещается к атомам кислорода и серы, имеющих большую элекроотрицательность, что позволяет протонам водорода легко отщепляться.
Проверка выполнения работы у доски и индивидуального практического задания. (выставление оценок)
III. Изучение нового материала
Актуализация знаний: ( 2 мин)
1. Какую степень окисления имеет сера в серной кислоте?
2. Можно ли предположить, какие свойства - окислительные или восстановительные будет проявлять сера в степени окисления +6? Почему?
3. Что в приведенных уравнениях реакции является окислителем: протон, водорода или сульфат- ион?
4. Можете ли вы привести пример реакции, когда окислителем в реакции является сульфат-ион?
5. Вернемся к нашей истории с монахом-алхимиком Василием Валентином. Какая жидкость могла отгоняться из железного купороса? Почему она дымила на воздухе?
6. Может ли концентрированная серная кислота взаимодействовать с металлами, стоящими в ряду напряжений после водорода? Какие продукты реакции получаются при взаимодействии конц. серной кислоты с активными металлами? Может ли конц. серная кислота взаимодействовать с органическими веществами?
Учитель: Ответ на последний вопрос мы с вами найдем самостоятельно. Класс заранее разбит на группы в зависимости от уровня подготовки ребят. Каждой группе дается отдельное практическое задание, записанное на инструктивной карточке. <Приложение 2>
На выполнение задания отводиться 7-8 минут.
Внимание! Перед самостоятельной работой необходимо провести четкий инструктаж по технике безопасности. Конц. серную кислоту в приборы заранее наливает лаборант или учитель. Во время урока лаборант должен находиться в кабинете для быстрого оказания мед помощи в случае необходимости.
Результаты исследования отправляются по локальной компьютерной сети в головной компьютер учителя или выполняются на больших листах бумаги ( для экономии времени и большей наглядности).
Самостоятельная исследовательская работа (7-8 мин)
Задание первой группе (укладка № 1): проведите опыт “Взаимодействие концентрированной серной кислоты с деревянной лучиной”
Задание второй группе (укладка №2): проведите опыт “Взаимодействие концентрированной серной кислоты с медью”
* Задание третьей группе (укладка №3): проведите опыт “Взаимодействие концентрированной серной кислоты с цинком”
* Задание четвертой группе(укладка № 4): проведите опыт “Взаимодействие концентрированной серной кислоты с алюминием”
* Задание пятой группе (укладка № 5): проведите опыт “Взаимодействие концентрированной серной кислоты с железом”
**Задание шестой группе (укладка № 6): проведите опыт “Взаимодействие концентрированной серной кислоты с магнием”
**Задание седьмой группе (укладка № 7): проведите опыт “Взаимодействие концентрированной серной кислоты с сахарной пудрой”
Обсуждение результатов (5-6 мин)
Во время обсуждения результатов ребята делают исправления и дополнения, если это необходимо. Синхронно ими ведутся записи.
Первая группа: Конц. серная кислота проявляет водоотнимающие свойства. Это свойство можно использовать в химическом процессе для сушки различных продуктов, например, газов.
Вторая группа: Конц. серная кислота при нагревании может взаимодействовать с металлами, расположенными в ряду напряжений металлов правее водорода. При этом продутом реакции является сернистый газ.
![]()
В этой реакции серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления.
Третья группа: При взаимодействии конц. серной кислоты с цинком возможно образование сернистого газа и серы.
![]()
В этих реакциях серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления.
Четвертая группа: Холодная конц. серная кислота пассивирует алюминий, образуя на его поверхности тонкую пленку, нерастворимую в серной кислоте.
Горячая конц. серная кислота является более сильным окислителем и взаимодействует с алюминием. При этом образуются следующие продуты реакции:
![]()
В этих реакциях серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления.
Пятая группа: Холодная конц. серная кислота пассивирует железо, образуя на его поверхности тонкую пленку, нерастворимую в серной кислоте.
Горячая конц. серная кислота является более сильным окислителем и взаимодействует с железом. При этом образуются следующие продуты реакции:
![]()
В этих реакциях серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления.
Шестая группа: При взаимодействии конц. серной кислоты с магнием возможно образование серы и сернистого газа.
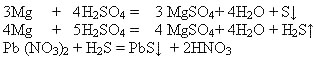
В этих реакциях серная кислота проявляет окислительные свойства, так как сера максимально понижает свою степень окисления .
Седьмая группа: Конц. серная кислота проявляет водоотнимающие свойства. Она окисляет сахарозу, при этом образуются летучие газы диоксид углерода и диоксид серы, поэтому масса вспучивается и поднимается.
![]()
В этой реакциях серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления .
Учитель: Обратим внимание на ваши записи в таблице и сделаем обобщение: какими же особыми свойствами обладает концентрированная серная кислота?
Ученик: Конц. серная кислота проявляет водоотнимающие свойства. В приведенных химических реакциях серная кислота проявляет только окислительные свойства. Это можно объяснить тем, что сера находится в ней в высшей степени окисления.
Учитель: Как вы думаете, от каких факторов зависит степень окисления продукта реакции при взаимодействии конц. серной кислоты с металлами?
Ученик: Степень окисления продукта реакции зависит от активности металла, чем активнее металл, вступающий в реакцию с концентрированной серной кислотой, тем ниже степень продута восстановления серы.
Учитель: Кроме реакций окисления металлов, концентрированная серная кислота способна окислять и неметаллы. Как вы думаете, какие продукты образуются при взаимодействии конц. серной кислоты с неметаллами?
Ученик: Скорее всего, это будут оксиды неметаллов. В общем виде это можно записать так:
НеМет + H2SO4 = НеМетО + Н2О
IV. Закрепление (8 мин)
Учитель: Теперь, ребята, с опорой на полученные знания попробуем ответить на следующие вопросы:
Вы открыли склянку с вязкой бесцветной жидкостью и увидели выделяющийся из нее белый дым. Когда в склянку опустили лучину, то ее конец обуглился. Какое вещество находиться в склянке?
Ученик: Скорее всего, в склянке находится конц. серная кислота. Но для окончательного результата необходимо ее разбавить и провести качественную реакцию с хлоридом бария.
Учитель: На заводе долгое время перекачивали серную кислоту из хранилища в цех по стальному трубопроводу. Но однажды трубы дали течь, и цех был залит кислотой. Выяснение обстоятельств аварии показало, что, нарушая правила технологии, трубопровод целый год использовали для транспортировки кислоты, имеющей не 93%, а 45% концентрацию. Почему изменение концентрации кислоты вызвало коррозию трубопровода? Приведите уравнение реакции.
Ученик: Конц. серная кислота пассивирует железо и реакция не протекает, а разбавленная серная кислота быстро и легко реагирует с ним. Поэтому стальные трубы вступили в реакцию с 45% серной кислотой, толщина их стенки постепенно истончилась и они дали течь.
Этот процесс можно выразить следующим уравнением реакции: Fe + H2SO4 = FeSO4+ H2
Учитель: В руки учителя на экзамене попала шпаргалка ученика, он оборвал окончания уравнений, и ученику пришлось самом дописывать продукты реакций. Закончите уравнения и расставьте коэффициенты в уравнении методом полуреаций. Сделайте вывод об окислительно- восстановительных свойствах конц. серной кислоты.
S + HNO3 конц = S + H2SO4 конц.
Ученик:
S + HNO3 конц =
Учитель: Целью сегодняшнего урока было: изучить свойства концентрированной серной кислоты, сравнить их со свойствами разбавленной серной кислоты и найти причину этих отличий. С этой задачей мы с вами успешно справились. Таким образом цель урока достигнута.
Теперь давайте попытаемся выяснить, что же мы узнали о свойствах концентрированной серной кислоты.
V. Самостоятельная работа, демонстрируется через проектор или кодоскоп. (5 мин)
Учитель: Поставьте себе оценки самостоятельно.
критерии оценки: нет ошибок — 5; одна ошибка — 4; две ошибки — 3.
VI. Домашние задание: повторить материал о соединениях серы в степени окисления -2; +4; +6.Выполнить дом. контрольную работу с самостоятельным выбором заданий. Каждое задание имеет свой оценочный бал в зависимости от уровня сложности. Работа написана на отдельных карточках, раздается индивидуально. <Приложение 4>
Критерии оценки: 21 б и выше — отлично; 15-20 б — хорошо; 12-14 б — удовлетворительно.
VII. Рефлексия (2 мин)
Учитель: Наш урок подошел к концу. Как вы считаете, что сегодня удалось, а что нет? Почему? Оцените свою активность на уроке по пятибалльной системе. (на столах имеются карточки с баллами).
Поднимите руки те, кому было сегодня интересно.
Поднимите руки те, кому было сегодня трудно.
Поднимите руки те, кому было сегодня легко.
Спасибо, урок окончен, все свободны.
Литература
1. Гузей Л.С. Химия-10, М: Дрофа. 2002.
2. Гузей Л.С. Методические рекомендации 10- 11 кл, М: Дрофа. 2002.
3. Степин Б.Д. Аликберова Л.Ю. Занимательные задания и эффектные опыты по химии М.: Дрофа. 2002. 430 с.
4. Хомченко Г.П. Пособие для поступающих в Вузы М.: Просвещение. 1992.
Домашняя контрольная работа