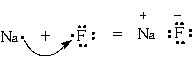Современная система образования отмечает, что результатом образования должны стать не только знания, умения и навыки, но и овладение средствами, помогающими организовать самообразование. Технология «Развитие критического мышления через чтение и письмо» направлена на формирование следующих умений:
- Работать с увеличивающимся и постоянно обновляющимся информационным потоком в разных областях знаний;
- Пользоваться различными способами интегрирования информации;
- Задавать вопросы, самостоятельно формулировать гипотезу;
- Преодолевать возникающие трудности;
- Вырабатывать собственное мнение на основе осмысления различного опыта, идей и представлений;
- Выражать свои мысли устно и письменно, ясно, уверенно и корректно по отношению к окружающим;
- Аргументировать свою точку зрения и учитывать точки зрения других;
- Самостоятельно заниматься своим обучением;
- Брать на себя ответственность; участвовать в совместном принятии решения;
- Выстраивать конструктивные взаимоотношения с другими людьми; сотрудничать и работать в группе.
Комбинируя приемы, можно планировать уроки в соответствии с уровнем зрелости своих учеников и объемом подлежащего усвоению конкретного материала. Учащиеся постепенно осваивают трехфазную модель учения и обучения («Вызов – осмысление- размышление»), «более уверенно ведут себя на уроке и более осознанно и целенаправленно регулируют свой мыслительный процесс».
Тема урока. Систематизация и коррекция ЗУН по теме «Химическая связь» (11 класс)
Задачи урока: Образовательные
- актуализировать ранее полученные знания,
- обобщить и систематизировать сведения о химической связи,
- обучать учащихся целенаправленному нахождению информации в тексте и её применению в работе.
Воспитательные
- формировать терпимость к чужому мнению, умение работать в команде, ответственность за выполнение задания,
- воспитывать внимательное отношение к другим людям, самостоятельность.
Развивающие
- развивать логику, критическое мышление, устную и письменную речь.
Все знают игру “Puzzle”, где из маленьких фрагментов складывается общая картинка. Метод «Пазл» разработан по тому же принципу, только вместо картинки собирается текст на определенную тему, а в качестве фрагментов используются карточки с отрывками текста. Информация, написанная на карточках неполная, но в каждой карточке содержится «ключ» (какое-либо слово, намёк, фраза) к поиску следующей.
Оборудование: плакаты для работы групп с указанием одного вида химической связи, 5 одинаковых наборов карточек – фрагментов (Таблица 1).
Стадия вызова. Класс делится на 5 групп. Учитель сообщает ученикам тему урока. Для активизации знаний обсуждаются вопросы:
- Что такое химическая связь
- Какие возможности завершения внешнего энергетического уровня есть у атома кальция? азота? хлора? Какие заряды возникнут на атомах, если эти возможности будут реализованы?
- Какой элемент более электроотрицателен: углерод или фтор, кислород или сера? Почему?
- Определите вид химической связи в веществах: KCl, Br2, P2O5, Al2S3, NH3, S8.
Ставится задача сравнить виды химической связи, т.е. выявить общие черты и отличия. Далее учитель вкратце объясняет ученикам дальнейший ход урока (только то, что касается стадии осмысления).
Стадия осмысления. Каждая группа получает лист бумаги (плакат), в середине которого написан вид химической связи (ковалентная неполярная, ковалентная полярная, ионная, металлическая, водородная). Каждая группа получает также конверт с карточками, которые содержат отрывочные сведения обо всех видах связи. Задача группы: собрать сведения о том виде связи, который указан у нее на плакате. Далее необходимо расположить эти фрагменты на плакате в логической последовательности, которая может быть различна. Фрагменты можно соединить стрелками, указав последовательность рассуждений. Можно дополнять полученную схему данными, которых нет на карточках, но известны учащимся.
Когда группы заполнили свои плакаты карточками, учитель предлагает прочитать составленные рассказы, объясняя логические связи, дополняя информацию, выделяя общие с другими видами связи черты и различия. Ученики в группе сами выбирают выступающего или выступающих. Представители одной группы выступают, все остальные внимательно слушают – это необходимо для дальнейшей работы.
Стадия рефлексии. После того как все группы прочитали вслух свои рассказы, учитель собирает все плакаты. После этого учащимся предлагается индивидуальная работа - написать рассказ о виде связи, о котором рассказывала другая группа. Работы собираются и оцениваются.
Таблица 1
|
Этот тип связи характерен для соединений типичных металлов с типичными неметаллами. |
Cоединения с данным видом связи представляют собой твердые, прочные, тугоплавкие вещества. Растворы и расплавы их – электролиты. |
При образовании связи не происходит полного перехода электронов. Данная связь является крайним случаем ковалентной полярной связи. |
NaCl, KOH, ZnO, Li2CO3, … |
Связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. |
|
Ионы - это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов. |
Многие неорганические соединения, которые образуются с помощью данной связи, являются тугоплавкими, обладают высокой твёрдостью и износостойкостью. К ним принадлежат некоторые карбиды, силициды, бориды, нитриды (в частности, известный боразон BN), нашедшие применение в новой технике. |
В молекуле аммиака каждый атом завершил свою электронную оболочку до конфигурации благородного газа: азот приобрел восемь (октет) электронов, атомы водорода получили в пользование по два электрона. При этом у азота имеется неподеленная пара электронов, за счет которой он может образовать четвертую химическую связь с частицей, обладающей вакантной орбиталью. В качестве такой частицы может выступить катион водорода Н+. |
Донор имеет электронную пару, акцептор – свободную орбиталь, которую эта пара может занять. |
Эти связи очень важны в соединениях углерода. Имея четыре валентных электрона, атом углерода может приобрести полный октет, если он предоставит эти электроны для образования общих электронных пар с четырьмя атомами водорода. |
При взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому. |
Механизм образования такой связи может быть обменный или донорно-акцепторный. |
HCl, H2O, Cl2O7, CH4, SiO2, … |
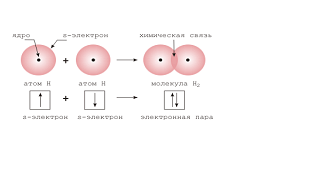
Связь, возникающая между атомами за счет образования общих электронных пар. |
При взаимодействии атомов с одинаковой электроотрицательностью образуются молекулы с данной связью. |
H2, Cl2, O2, O3, N2, S8, P4, … |
|
Вещества молекулярного строения. При обычных условиях большинство таких веществ представляют собой газы (F2, O2) или твердые вещества (P4, S8) и лишь единственный бром (Br2) является жидкостью. Все эти вещества летучи, в твердом состоянии они легкоплавки, способны к возгонке. |
Общие электронные пары будут находиться посередине между ядрами двух связывающихся атомов, поскольку ядра притягивают общие электронные пары с равной силой. |
Вещества атомного строения образованы длинными цепями атомов (Cn, Bn, Sin Sen, Ten), имеют высокую твердость, высокие температуры плавления и кипения, а летучесть их мала. |
|
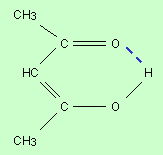
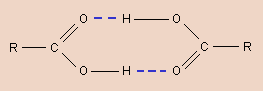
Связь образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом (N, O, S и др.), и неподеленной парой электронов другого атома (обычно O, N).
|
Связь приводит к ассоциации одинаковых или различных молекул в комплексы; во многом определяет свойства воды и льда, молекулярных кристаллов, структуру и свойства многих синтетических полиамидов, белков, нуклеиновых кислот. |
|
Исключительно важную роль эта связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. Если бы эти связи отсутствовали, то вода плавилась бы при –100°С, а кипела при –80°С. |
|
Связь, которая образуется в результате взаимодействия относительно свободных электронов с ионами металлов. |
Особый тип связи определяет все их общие свойства: электропроводность, теплопроводность, пластичность, блеск. |
Этот тип связи характерен для простых веществ- металлов. |
Связь характеризуется ненаправленностью. Это означает, что в кристалле невозможно выделить пару атомов, связанных только друг с другом. Каждый атом в равной мере связан со всеми своими соседями по узлам кристаллической решетки. |
Благодаря этим связям происходит точное копирование молекулы ДНК, передающей из поколения в поколение всю генетическую информацию; эти связи определяют специфичность действия многих лекарственных препаратов; ответственны они и за вкусовые ощущения, и за способность наших мышц сокращаться... |
|
Строение атома характеризуется небольшим числом электронов на внешнем энергетическом уровне, т.е. число вакантных орбиталей у них значительно больше числа валентных электронов. |
Атомы сближаются до такой степени, что их вакантные орбитали начинают перекрываться. Валентный электрон при этом может относительно свободно перемещаться с орбитали своего атома на свободную и близкую по энергии орбиталь соседних атомов. Потеряв электрон, исходный атом теряет свою электронейтральность и превращается в катион: |
Литература.
Габриелян О.С., Лысова Г.Г. Химия. 11 класс: учебник для общеобразовательных учреждений. М: Дрофа, 2005.