Цели: Разъяснить физическую природу электропроводности жидких проводников, осуществить вывод закона электролиза в свете электронных представлений, научить учащихся применять закон при решении задач.
Комплексное методическое обеспечение:
- приборы для демонстрации опыта,
- дополнительная литература,
- учебник физики 10 кл.,
- портреты ученых: Б.С. Якоби, М.М. Фарадей
План-конспект
1. Вступительное слово преподавателя
С электропроводностью растворов солей в воде связано очень многое в нашей жизни.
С первого удара сердца (“живое” электричество в теле человека, на 80% состоящем из воды) до автомобилей на улице, плееров и мобильных телефонов (неотъемлемой частью этих устройств являются “батарейки” - электрохимические элементы питания и различные аккумуляторы - от свинцово-кислотных в автомобилях до литий-полимерных в самых дорогих мобильных телефонах”. В огромных, дымящихся ядовитыми парами чанах из расплавленного при огромной температуре боксита электролизом получают алюминий - “крылатый” металл для самолетов и банок для “фанты”. Все вокруг - от хромированной решетки радиатора иномарки до посеребренной сережки в ухе когда-либо сталкивалось с раствором или расплавом солей. А, следовательно, с электрическим током в жидкостях. Не зря это явление изучает целая наука - электрохимия, но нас сейчас больше интересуют физические основы этого явления
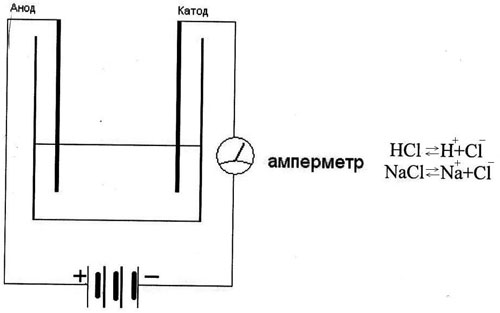
2. Демонстрация опыта:
Дистилированная вода не проводит ток в собранной установке. Лампочка не загорается, а если добавим в эту воду немного кислоты или соли, то в цепи появится ток и лампочка загорит. Происходит распад молекулы на (+) и (-) ионы, электролитическая диссоциация (связь с химией).
“Атомы вещества каким-то образом одарены электрическими силами или связаны с ними, и им они обязаны своими наиболее замечательными качествами.” (М. Фарадей)
Вывод: электронная и ионная проводимость растворов
3. Электролиз
Электрический ток в растворах и расплавах электролитов приводит к выделению на электродах веществ, входящих в состав электролита. Это явление называется электролизом и в 1800 году его открыли английские ученые У. Никольсон и А. Карлей, а исследовал - английский физик М. Фарадей в 1834 году, он также ввел термины: катод, электроды, анод, электролиз, электролиты.
4. Закон Фарадея (1843 год)
Масса вещества, выделившегося на электроде за
время при прохождении электрического тока,
пропорциональна силе тока и времени, где![]() - электрохимический
эквивалент вещества.
- электрохимический
эквивалент вещества.
“Электролиз важно знать, чтобы массу рассчитать, которая в растворе выделяется, когда в нем токи появляются. Пусть в растворе будет медный купорос, на катоде видим меди прирост. Масса меди будет больше при том, если токи больше времени в нем. Не простой ведь он, Фарадея, англичанина закон”.
![]()
5. Применение электролиза (работа по учебнику)
а) электролитический метод получения чистых металлов (рафинирование). Хорошим примером является электролитическое очищение меди, драгоценных металлов - золото и серебро.
б) посредством электролиза можно покрыть металлические предметы слоем другого металла. Этот процесс называется гальваностегией. Особое техническое значение имеют покрытия трудноокисляемыми металлами: никелирование и хромирование.
в) гальванопластика- изготовление рельефной копии предмета. Этот процесс был разработан русским ученым Б. С. Якоби (1801-1874 г.), который в 1836 году применил этот способ для изготовления полых фигур для Исаакиевского собора в Санкт-Петербурге
г) получение оксидных защитных пленок на металлах (анодирование)
д) электрохимическая обработка поверхности металлического изделия (полировка)
е) электрохимическое окрашивание металлов (медь, латунь, цинк)
ж) очистка воды – удаление из нее растворимых примесей, в результате получается так называемая мягкая вода
з) электрохимическая заточка режущих инструментов (хирургические ножи, бритвы)
6. Сообщение: биография М. Фарадея.

Фарадей Майкл (1791-1867) - английский физик, основоположник учения об электромагнитном поле, иностранный почетный член Петербургской А. Н.(1830). Обнаружил химическое действие электрического тока, взаимосвязь между электричеством и магнетизмом, магнетизмом и светом. Открыл (1831 г) электромагнитную индукцию-явление, которое легло в основу электротехники. Установил (1833-1834 г.) законы электролиза, открыл пара- и диамагнетизм, вращение плоскости поляризации света в магнитном поле. Даже далеко не полный перечень того, что внес в науку Фарадей, дает представление об исключительном значении его трудов.
Точка зрения на электродинамику с позиций концепции поля, основоположником которой был Фарадей, стала неотъемлемой частью современной науки. Труды Фарадея ознаменовали наступление новой эры в физике.
7. Сообщение: Якоби Борис Семенович (Мориц Герман) (1801-1874 г.)

Российский физик и электротехник, академик Петербургской А Н(1842г), родился в Германии, с 1835 г проживал в России. Много трудов по практическому применению электричества, изобрел электродвигатель(1834г) и опробовал его для привода судна (1838г). Создал гальванотехнику(1838г), несколько типов телеграфных аппаратов (1840-1850г) Исследовал электромагниты совместно с Э. Х. Ленцем. Труды по военной электротехнике, электрическим измерениям, метеоролог.
8. Решение задач (устно):
1) Почему нельзя прикасаться к неизолированным электрическим проводам голыми руками? (Влага на руках всегда содержит раствор различных солей и является электролитом поэтому создает хороший контакт между проводами и кожей)
2) Почему для гальванического покрытия изделия чаще используют никель и хром? (большая химическая стойкость, механическая прочность и после полировки дают красивый блеск)
3) Почему провода осветительной сети обязательно имеют резиновую оболочку, а провода, предназначенные для сырых помещений кроме того, еще просмолены снаружи?
(так как влага на проводах представляет электролит и является проводником, а это может привести к короткому замыканию и пожару)
4) (письменно) с комментариями у доски упр. 20 (4,5,7) стр.343-344 физика-10 Г.Я.Мякишев
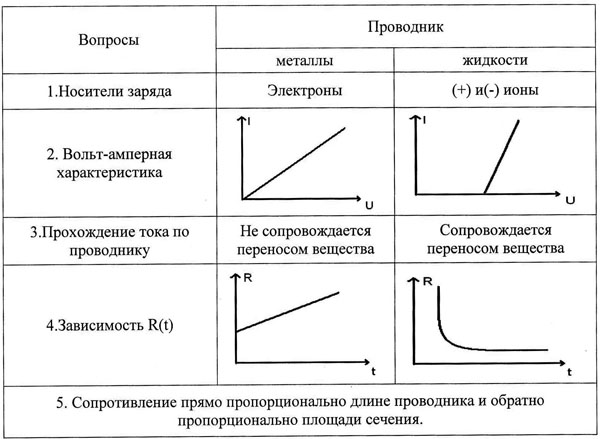
9. Заполнение таблицы: “Сходства и различия в электропроводности металлов и жидкостей”.
10. Подведение итогов урока, выставление оценок.