Цель: на основании положения в периодической системе химических элементов, строения атома железа учащиеся должны составить представление о физических и химических свойствах железа.
Реактивы. На демонстрационном столе опилки железа, серная кислота (разбавленная), раствор сульфата меди (2), речной песок, вода дистиллированная. Штатив с пробирками, пипетки, пробка с газоотводной трубкой, стакан, лабораторный штатив, спиртовка.
На ученических столах - серная кислота (разбавленная), сульфат меди (2), опилки железные, штатив с пробирками, пипетки.
Оборудование: карта «Минеральные ресурсы» и таблица «План урока». Коллекция «Полезные ископаемые»; 3 конверта с заданиями.
Ход урока
1. Изучение нового материала.
УЧИТЕЛЬ. Ребята! Послушайте отрывок из «Поэмы о периодическом законе», В. Половняк.
Громоподобные раскаты
И в небе раскаленный след:
На землю новый камень падал
И ужасался человек
Но редким был подарок неба
Им лишь счастливец обладал:
Топор был выкован железный,
Сверкает лезвием кинжал.
Вот длинный ряд тысячелетний
Приходит в поисках, в борьбе,
И наступает век железный
Кровавый беспокойный век.
Проблемный вопрос: на каком древнем языке железо именуют «небесным камнем»?
(ученики выдвигают версии на поставленный вопрос).
Сообщение ученика. 30 июня 1908 году эвенка Чучанги рассказывал: тут я увидел страшное диво - лесины падают, хвоя горит. Жарко очень. Жарко сгореть можно. Вдруг над горой, где уже упал лес, стало сильно светло, будто второе солнце появилось. Эту местность эвенки стали называть «страной мертвого леса», площадь радиусом 25-30 км после падения метеорита.
При падении Тунгусского метеорита по всей Центральной Сибири был виден ослепительно-яркий свет. Установлено, что в земную атмосферу со скоростью 70 км/с влетело метеоритное тело массой 1000000 т. Удары огромной силы, подобные взрывам, были слышны, в тысяче километров от места падения! Куски «небесного тела», которые называют «метеоритами», бывают похожи на камни черно-бурого цвета. В свободном состоянии железо встречается только в метеоритах. Ежесуточно на Землю выпадают до 10 т метеоритного вещества.[3]
УЧИТЕЛЬ. Итак, запишите в свои тетради тему урока: Железо. Строение атома, физические и химические свойства.
Цель урока: на основании положения в периодической системе химических элементов, строение атома железа составить представление о физических и химических свойствах железа.
1. Строение и свойства атомов.
Что можно дополнительно сказать о железе на основании положения его в периодической системе химических элементов? (Ученики сообщают - 8 группа, побочная подгруппа, 4 большой период, d-элемент. Химическое знак – Fe. Порядковый номер – 26. Относительная атомная масса (Ar) – 56).
УЧИТЕЛЬ. А теперь я прошу вас написать строение атома, электронную и графическую формулы железа?( к доске приглашаются ученики).
Ученики составляют следующую запись:
Схема строения атома: Fe +26 )2 )8 )14 )2.
Электронная формула атома 1s2 2s2 p6 3s2 p6 4s2 3d6.
Графическая схема:
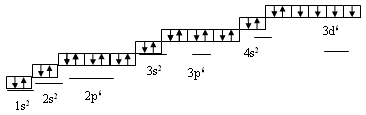
В соединениях железо проявляет степень окисления, в основном +2 и +3, реже +4 и +6. Как и всегда при изучении соединений, мы рассмотрим физические свойства железа:
2. Физические свойства железа.
Вашим помощником на этом уроке будет таблица «План урока», которая висит на доске ( см. приложение). Прошу вас использовать ее в работе на сегодняшнем уроке. (Учитель демонстрирует опилки железа). Начнем с физических свойств железа. Блестящий серебристо-белый металлический. Один из наиболее распространенных элементов в природе, по содержанию в земной коре (4,65% по массе) уступает лишь кислороду, кремнию и алюминию. Оно входит в состав многих оксидных руд – гематита, или красного железняка Fe2O3, магнетита Fe3O4, пирита FeS2 и др.
Комментируя руды, учитель демонстрирует коллекцию «Полезные ископаемые» и просит учеников на карте «Минеральные ресурсы», найти основные месторождения и назвать их?
УЧИТЕЛЬ. Сравним атомный радиус железа 0,126 нм с атомным радиусом натрия 0,186 нм, магния 0,16 нм, алюминии 0,14 нм. Какое влияние на свойства железа оказывает такие размеры атома и возможность отдавать электроны c внешнего и предпоследнего слоя?
Железо, имеющее атомы небольших размеров и большое число электронов, участвующих в металлической связи, должно обладать высокой температурой плавления и значительной твердостью, но вместе с тем сравнительно небольшой электропроводностью. Железо тугоплавкое – tпл = 1539°С, относительно мягкое (по школе твердость его равна 4), способен сильно притягиваться магнитами.
У железа есть две аллотропные модификации: альфа-железа устойчивое до 910°С, имеет кубическую объемно-центрированную решетку; гамма-железо t=910 – 1400°С – кубическую гранецентрированную.
Железо может отдавать электроны, находящиеся на двух ( внешнем и предпоследнем) слоях. Проявляет восстановительные свойства. Степень железа зависит от окислительной способности реагирующих с ним веществ. Итак, химические свойства железа:
3. Химические свойства железа.
Познакомимся с химическими свойствами железа: искры, вырывающиеся при резке стального инструмента, представляет с собой раскаленные частички окалины. В кислороде железо сгорает, разбрасывая искры – частички железной окалины Fe3O4.
Свойства №1 Взаимодействия железа с кислородом:
![]()
![]() промежуточный оксид
промежуточный оксид
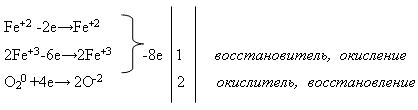
Свойства №2 Взаимодействие железа с водой:
Учитель пишет на доске уравнение реакции и просит уравнять его с помощью электронного баланса. Это задание выполняет ученик у доски, а остальные – на своих рабочих местах:
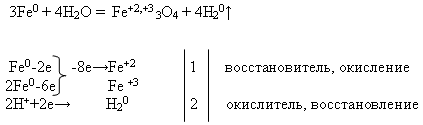
Затем учитель проводит демонстрацию опыта «Взаимодействия железа с водой» (см. приложение).
Свойство №3 Взаимодействие железа с разбавленными кислотами:
УЧИТЕЛЬ. Используя предложенные вам реактивы, проведите химическую реакцию, о которой идет речь. Напишите уравнение реакции в молекулярном и ионном виде. Докажите, что железо в данном процессе проявляет свойство восстановителя.
Учитель приглашает к доске ученика, который проводит эксперимент и записывает уравнение реакции, а остальные выполняют предложенное задание на своих рабочих местах:
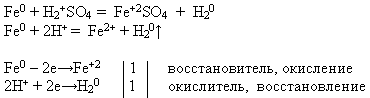
В электрохимическом ряду напряжений металлов железо расположено до водорода. Поэтому оно растворяется в разбавленных серной и соляной кислотах, вытесняя из них водород и образуя соответствующую соль, степень окисления +2.
Свойства №4 Взаимодействие с растворами солей:
УЧИТЕЛЬ. Используя предложенные вам реактивы, проведите химическую реакцию, о которой идет речь. Напишите уравнение реакции в молекулярном и ионном виде – это задание делают ученики первого варианта, а ученики второго варианта – докажите, что железо в данном процессе проявляет свойство восстановителя.
Учитель приглашает к доске ученика, который проводит эксперимент. А остальные выполняют предложенное задание на своих рабочих местах:
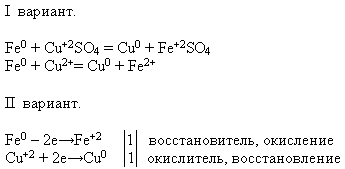
2. Подведем итоги урока по таблице «План урока»
3. Закрепление материала.
УЧИТЕЛЬ. Ребята! К нам на урок химии прислали три конверта, в них помещены задания для тех, кто хочет получить отметку «5» и «4». Приглашаю к доске желающих. Ученикам, работающим на своих местах, можно выполнить задание по своему усмотрению.
№1 конверт (за правильно выполненное задание – «5»).
| Какой объем оксида углевода (2) потребуется для восстановления железа из 2,32 кг магнитного железа ( |
№2 конверт (за правильное выполненное задания – «4»).
| Напишите два уравнения реакции железа с концентрированной серной кислотой, в которой продуктом восстановления кислоты будет соответственно оксид серы(4) |
УЧИТЕЛЬ. Ребята! У нас еще остался конверт (учитель показывает конверт). Что же здесь находится? (Учитель вскрываетконверт и читает). Домашнее задание (записывает на доске домашнее задание).
Учить §14 до статьи «Соединение железа», по рабочей тетради тема «Железо» №3-4 письменно.
Завершая знакомство со свойствами железа, хочу напомнить, насколько химия многолика. Она дает ученику огромные возможности, но при этом требует ответственного отношения и понимания химических реакций. Надеюсь, что полученные сведения окажутся вам полезными.
Комментирую отметки учащихся.
ЛИТЕРАТУРА:
- Бусев А.И., Ефимов И.П., Определения, понятия, термины в химии. Просвещение 1981.
- Габриелян О.С. Химия 9 класс Дрофа,2001.
- Гонтарук Т.И. автор- составитель. Я познаю мир. Детская энциклопедия. АСП 1999, с. 294-297.
- Полосин В.С. Школьный эксперимент по неорганической химии. Просвещение 1970.
- ТретьяковЮ.Д. Справочные материалы. Просвещение 1988.