Учебник: Рудзитис Г.Е, Фельдман Ф.Г. Химия: учебник для 9 класса общеобразовательных учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – 12-е изд. – М.: Просвещение, ОАО “Московские учебники”, 2009. – 191 с.
Задачник: Гольдфарб Я.Л., Ходаков Ю.В., Додонов Ю.В. Задачник: 8–11 классы: учебное пособие для общеобразовательных учебных заведений. – М.: Дрофа, 2005. – 272 с.
Цель: сформировать представление учащихся о взаимосвязи способов получения, свойств и применения веществ в ходе составления характеристики азотной кислоты.
Задачи:
- способствовать систематизации понятийного аппарата: вещество, электролит, ион, заряд иона, гидроксид, кислота, химические свойства азотной кислоты, общие свойства кислот, специфические свойства азотной кислоты, степень окисления химического элемента, окислитель, восстановитель, взаимосвязь способов получения, свойств и применения азотной кислоты на уровнях:
“5” – обосновать, доказать; “4” – характеризовать, применить; “3” – рассказать;
- способствовать совершенствованию специальных предметных умений: составлять формулы веществ по степени окисления химических элементов (по зарядам ионов), уравнения химических реакций с участием азотной кислоты;
- способствовать формированию общеучебных умений:
а) учебно-интеллектуальных
(анализировать факты, устанавливать
причинно-следственные связи; выдвигать гипотезу;
сравнивать кислоты по свойству реагирования с
металлами; делать выводы);
б) учебно-информационных (работать с текстом);
в) учебно-организационных (понимать смысл
задания, распределять время для выполнения
заданий планировать работу по организации
работы, осуществлять
самоконтроль);
г) учебно-коммуникативных (сотрудничать в
группе).
- способствовать формированию критического мышления учащихся (критически оценивать собственные знания по теме и сопоставлять их с научными);
- создать условия для формирования партнерских отношений между учениками через включение их в групповую форму работы.
Форма проведения: урок с включением групповых, индивидуальных форм организации учебно-познавательной деятельности учащихся с использованием ИКТ.
Продолжительность учебного занятия: 45 минут.
Использование педагогических технологий: метод проблемного обучения, обучение в сотрудничестве
Элементы содержания, проверяемые заданиями КИМ ГИА (приводятся в приложении 1).
Умения и виды деятельности, проверяемые КИМ ГИА (приводятся в приложении 1)
Элементы содержания, проверяемые заданиями КИМ ЕГЭ (приводятся в приложении 1).
Умения и виды деятельности, проверяемые КИМ ЕГЭ (приводятся в приложении 1).
Маршрут путешествия (тема урока и маршрут путешествия представлен на слайде № 1, презентация)
- Станция историческая
- Станция химическая
- Станция практическая
Ход урока
Организационный момент – 1 мин:
Мобилизующее начало (приветствие, проверка готовности к уроку, организация внимания учащихся), информация о цели и ходе урока, мотивация.
Вступительное слово учителя: Сегодня мы отправимся в путешествие, во время которого мы должны будем вспомнить, что мы знаем о кислотах, об окислительно-восстановительных реакциях, реакциях ионного обмена. И конечно же, мы узнаем что-то новое.
Вспомним, по каким признакам классифицируют кислоты?
(Основность, содержание кислорода) – фронтальная беседа (1 мин).
Вывод (учитель): Значит, азотная кислота – сильная кислородсодержащая одноосновная кислота, формула которой – HNO3
I. Первая станция – историческая.
Учащимся по группам предлагаются карточки (представлены в приложении № 2). На обсуждение каждой группе дается 2 мин, на ответы каждой группе – 1 мин)
Вывод (учитель, слайд № 2, презентация,1 мин):
Итак, с древности (с VIII века) существовал способ получения азотной кислоты путём сухой перегонки:
а) селитры (NaNO3 или KNO3)
б) с квасцами (M+2SO4![]() M3+2(SO4)3
M3+2(SO4)3![]() 24H2O, где где M+ —
один из щелочных металлов (литий, натрий, калий, рубидий
или цезий, а M3+ —
один из трехвалентных металлов (обычно алюминий,
хром или железо(III)),
например, Na2SO4
24H2O, где где M+ —
один из щелочных металлов (литий, натрий, калий, рубидий
или цезий, а M3+ —
один из трехвалентных металлов (обычно алюминий,
хром или железо(III)),
например, Na2SO4![]() Fe2(SO4)3
Fe2(SO4)3![]() 24H2O
24H2O
в) медным купоросом (CuSO4![]() 5H2O).
5H2O).
Этот метод с теми или иными
модификациями, наиболее существенной из которых
была замена медного купороса железным (FeSO4![]() 7H2O), применялся в
европейской и арабской алхимии вплоть до XVII века,
когда немецкий химик И. Р. Глаубер предложил
получать азотную кислоту при умеренном
нагревании (до 150?C) калиевой селитры с
концентрированной серной кислотой:
7H2O), применялся в
европейской и арабской алхимии вплоть до XVII века,
когда немецкий химик И. Р. Глаубер предложил
получать азотную кислоту при умеренном
нагревании (до 150?C) калиевой селитры с
концентрированной серной кислотой:
KNO3 + конц. H2SO4 ![]() HNO3 + KHSO4.
HNO3 + KHSO4.
II. Вторая станция – химическая.
Учащимся предлагается вспомнить свойства кислот (взаимодействие с основными и амфотерными оксидами, основаниями, солями (согласно ряду кислот)), предлагается закончить уравнения реакций (слайд № 3, презентация), составив для них полные и сокращенные ионные уравнения:
а) CaО + HNO3 ![]()
б) CaCO3 + HNO3 ![]()
в) Cu(OH)2 + HNO3 ![]()
г) ZnO + HNO3 ![]()
д) NaOH + HNO3 ![]()
е) Na2SO3 + HNO3 ![]()
Учащиеся выполняют задание в тетради, отдельные учащиеся у доски. На выполнение задания отводится 12 мин, после чего учащимся предлагается проверить задание (слайд № 4, презентация):
а) CaО + 2HNO3 ![]() Сa(NO3)2 + H2O
Сa(NO3)2 + H2O
CaO + 2H+ + 2NO3– ![]() Ca2+ + 2 NO3– + H2O
Ca2+ + 2 NO3– + H2O
CaO + 2H+ ![]() Ca2+ + H2O
Ca2+ + H2O
б) CaCO3 + 2HNO3 ![]() Сa(NO3)2 + CO2 + H2O
Сa(NO3)2 + CO2 + H2O
CaCO3 + 2H+ + 2NO3– ![]() Ca2+ + 2 NO3– + CO2 +
H2O
Ca2+ + 2 NO3– + CO2 +
H2O
CaCO3 + 2H+ ![]() Ca2+
+ CO2 + H2O
Ca2+
+ CO2 + H2O
в) Cu(OH)2 + 2HNO3 ![]() Сu(NO3)2 + 2H2O
Сu(NO3)2 + 2H2O
Cu(OH)2 + 2H+ + 2NO3– ![]() Cu2+ + 2 NO3–
+ 2H2O
Cu2+ + 2 NO3–
+ 2H2O
Cu(OH)2 + 2H+ ![]() Cu2+
+ 2H2O
Cu2+
+ 2H2O
г) ZnO + 2HNO3 ![]() Zn(NO3)2 + H2O
Zn(NO3)2 + H2O
ZnO + 2H+ + 2NO3– ![]() Zn2+ + 2 NO3– + H2O
Zn2+ + 2 NO3– + H2O
ZnO + 2H+ ![]() Zn2+ + H2O
Zn2+ + H2O
д) NaOH + HNO3 ![]() NaNO3 + H2O
NaNO3 + H2O
Na+ + OH– + H+ + NO3– ![]() Na+ + NO3–
+ H2O
Na+ + NO3–
+ H2O
OH– + H+ ![]() H2O
H2O
е) Na2SO3 + 2HNO3 ![]() 2NaNO3 + SO2
+ H2O
2NaNO3 + SO2
+ H2O
2Na+ + SO32 – + 2H+ + 2NO3–
![]() 2Na+ + 2NO3–
+ SO2 + H2O
2Na+ + 2NO3–
+ SO2 + H2O
SO32 – + 2H+ ![]() SO2 + H2O
SO2 + H2O
Одновременно проводится фронтальная беседа (2 мин) по вопросам:
- К какому типу относятся все предложенные реакции?
- Почему все они протекают до конца?
- Какие вещества раскладываются на ионы, какие – не раскладываются и почему?
Далее разбираются специфические свойства азотной кислоты (объяснение учителя) – 18 мин.
1. Азотная кислота в любой концентрации проявляет свойства кислоты-окислителя, при этом азот восстанавливается до степени окисления от +4 до ?3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты. Как кислота-окислитель, HNO3 взаимодействует:
а) с металлами (учащимся раздаются таблицы (приложение 3)
Примеры уравнений ОВР (с электронными балансами). Одновременно повторяются правила составления уравнений ОВР. Слайд 5, 6 (презентация)
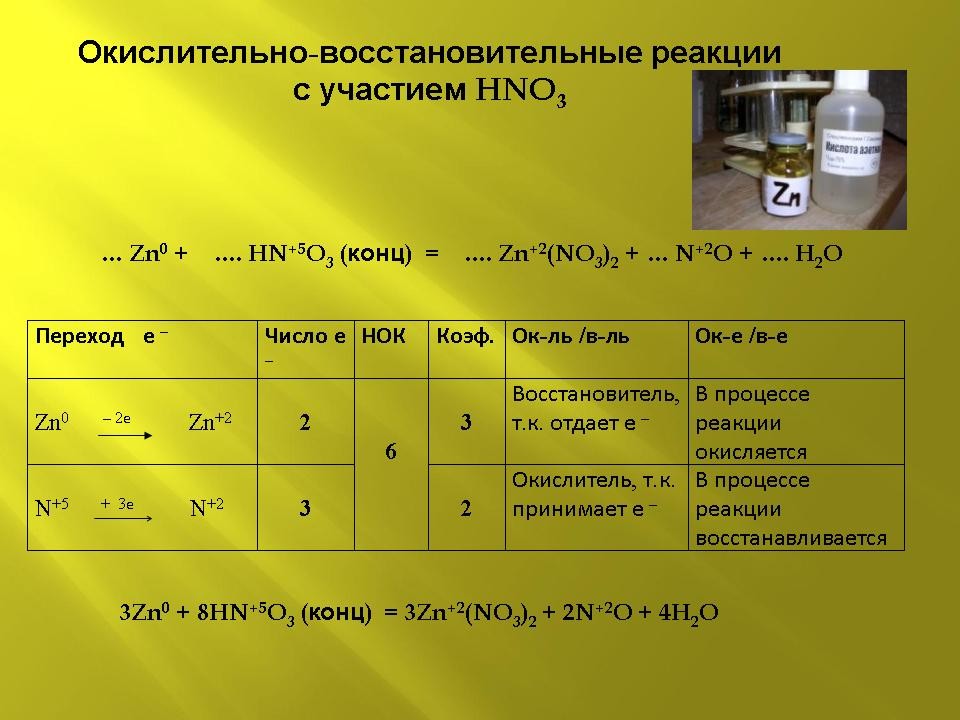
Слайд 5 (презентация):
3Zn0 + 8HN+5O3 (конц) ![]() 3Zn+2(NO3)2 +
2N+2O + 4H2O
3Zn+2(NO3)2 +
2N+2O + 4H2O
| Переход е – | Число е – | НОК | Коэф. | Ок-ль /в-ль | Ок-е /в-е |
| Zn0 – 2е |
2 |
6 |
3 |
Восстановитель, т.к. отдает е – | В процессе реакции окисляется |
| N+5 + 3е |
3 |
2 |
Окислитель, т.к. принимает е – | В процессе реакции восстанавливается |
Слайд 6 (презентация):
5Zn0 + 12HN+5O3 (разб) ![]() 5Zn+2(NO3)2 +
N20 + 6H2O
5Zn+2(NO3)2 +
N20 + 6H2O
| Переход е – | Число е – | НОК | Коэф. | Ок-ль /в-ль | Ок-е /в-е |
| Zn0 – 2е |
2 |
10 |
5 |
Восстановитель, т.к. отдает е – | В процессе реакции окисляется |
| 2N+5 + 5е |
10 |
1 |
Окислитель, т.к. принимает е – | В процессе реакции восстанавливается |
Отмечается, что в таблице (приложение 3) отражается только доминирующий ход реакции. Это означает, что, как правило, идет несколько реакций одновременно. Например, при взаимодействии Zn с HNO3 (с массовой долей 30%) в продуктах будет содержаться NO, NO2, N2O, N2 и NH4NO3.
Единственная общая закономерность при взаимодействии азотной кислоты с металлами: чем более разбавленная кислота и чем активнее металл, тем глубже восстанавливается азот:
увеличение концентрации кислоты ![]() NO2, NO, N2O,
N2, NH4NO3
NO2, NO, N2O,
N2, NH4NO3 ![]() увеличение активности металла
увеличение активности металла
Вводится понятие о пассивации металлов, как о переходе поверхности металла в неактивное, пассивное состояние, связанное с образованием тонких поверхностных слоёв соединений, препятствующих окислению
2. С неметаллами, при этом азот обычно восстанавливается до NO2 или NO
Приводятся примеры уравнений ОВР (с электронными балансами). Слайды 7,8 (презентация).
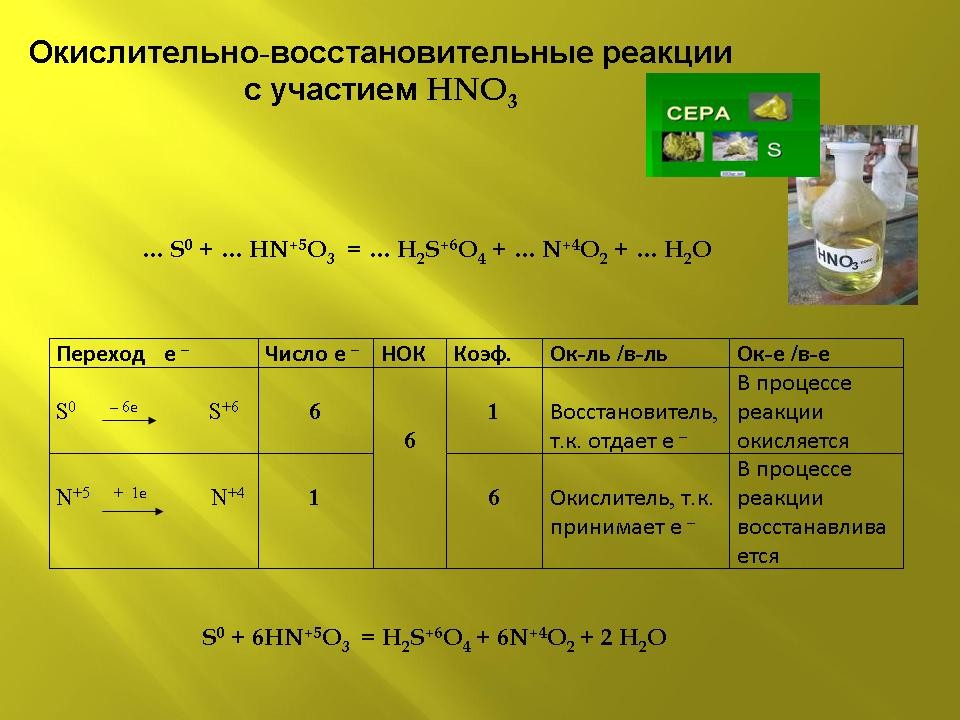
Слайд 7 (презентация).
S0 + 6HN+5O3 ![]() H2S+6O4 + 6N+4O2 + 2 H2O
H2S+6O4 + 6N+4O2 + 2 H2O
| Переход е – | Число е – | НОК | Коэф. | Ок-ль /в-ль | Ок-е /в-е |
| S0 – 6е |
6 |
6 |
1 |
Восстановитель, т.к. отдает е – | В процессе реакции окисляется |
| N+5 + 1е |
1 |
6 |
Окислитель, т.к. принимает е – | В процессе реакции восстанавливается |
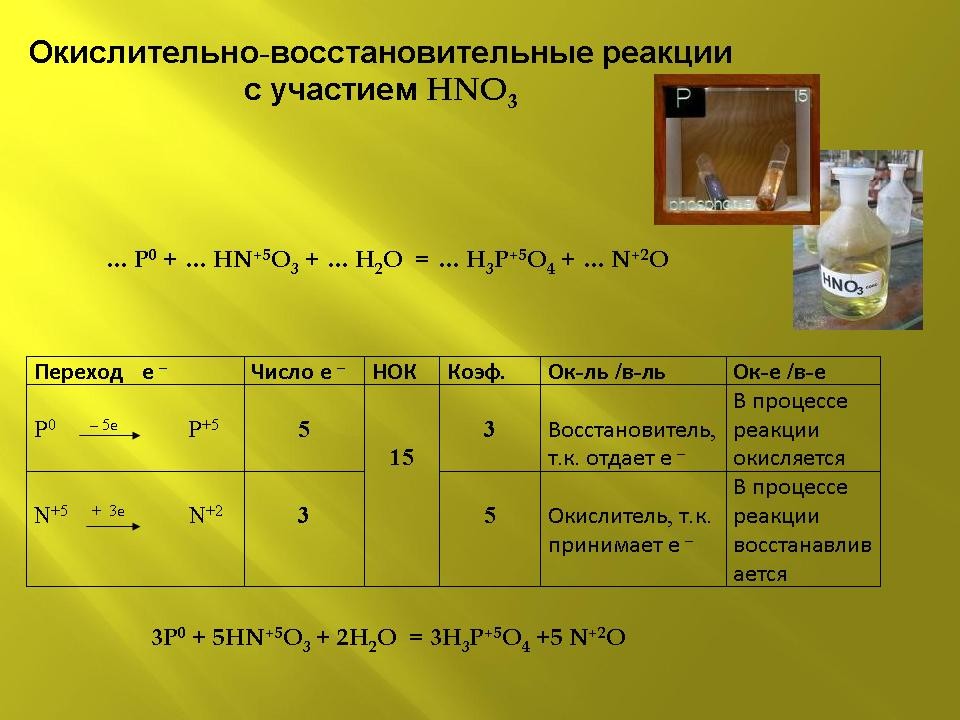
Слайд 8 (презентация).
3P0 + 5HN+5O3 + 2H2O![]() 3H3P+5O4 +5 N+2O
3H3P+5O4 +5 N+2O
| Переход е – | Число е – | НОК | Коэф. | Ок-ль /в-ль | Ок-е /в-е |
| P0 – 5е |
5 |
15 |
3 |
Восстановитель, т.к. отдает е – | В процессе реакции окисляется |
| N+5 + 3е |
3 |
5 |
Окислитель, т.к. принимает е – | В процессе реакции восстанавливается |
3. Концентрированная HNO3 разлагается на свету и при нагревании (слайд 9, презентация):
4HN+5O3 ![]() 4N+4O2 + 2H2O + O20
4N+4O2 + 2H2O + O20
| Переход е – | Число е – | НОК | Коэф. | Ок-ль /в-ль | Ок-е /в-е |
| 2O – 2 – 2е |
4 |
4 |
1 |
Восстановитель, т.к. отдает е – | В процессе реакции окисляется |
| N+5 + 1е |
1 |
4 |
Окислитель, т.к. принимает е – | В процессе реакции восстанавливается |
III. Третья станция – практическая.
Учащимся по группам предлагается задание – сравнить области применения азотной кислоты в конце XIX-начале XX в.в. и сейчас (текст на слайде, слайд 10, презентация).
Текст на слайде:
В энциклопедическом словаре Ф. А. Брокгауза и И. А. Ефрона (Петербург, 1890 – 1907 г.г.) говорится:
“Азотная кислота имеет множество применений, самых разнообразных, так напр., она массами идет на приготовление азотнокислого серебра (ляписа, адского камня), употребляемого в фармацевтическом и фотографическом деле, помощью ее же готовится из бензола и нитробензола (исходного вещества для фабрикации анилина и фуксина), нитроглицерин, хлопчатобумажный порох, пикриновая кислота, фталевая кислота, ализарин, гремучее серебро и т.п. С основаниями азотная кислота образует азотнокислые соли или нитраты, которые все (за исключением основного азотнокислого висмута) растворимы в воде и будучи брошены на раскаленный уголь дают более или менее сильную вспышку. Важнейшие из них — азотнокислый калий (селитра), азотнокислый натр (чилийская селитра), азотнокислый аммоний, азотнокислое серебро (ляпис, адский камень) и азотнокислое железо, употребляемое, как протрава в красильном деле при окраске шелка”.
Сейчас азотная кислота применяется:
- в производстве минеральных удобрений;
- в военной промышленности (в производстве взрывчатых и отравляющих веществ, как окислитель ракетного топлива);
- в фотографии — подкисление некоторых тонирующих растворов[2];
- в станковой графике — для травления печатных форм (офортных досок, цинкографических типографских форм и магниевых клише).
- в производстве красителей, лекарств
Учащимся предлагаются вопросы:
- изменились ли области применения азотной кислоты с XIX века?
- как именно изменилось и почему?
На обсуждение и ответ каждой группе дается 1 мин, затем – межгрупповое обсуждение – 1 мин)
В заключение предлагается слайд “Действие HNO3 на организм человека” (слайд 11, презентация) – 1 мин
Азотная кислота и её пары очень вредны: пары вызывают раздражение дыхательных путей, а сама кислота оставляет на коже долгозаживающие язвы. При действии на кожу возникает характерное желтое окрашивание кожи, обусловленное ксантопротеиновой реакцией. При нагреве или под действием света кислота разлагается с образованием высокотоксичного диоксида азота NO2 (газа бурого цвета).
Домашнее задание (слайд № 12, презентация, 1 мин)
§ 19, упр. 4, 7 стр. 59 (учебник), упр. 14-82, 14-83 стр. 144 (задачник), составить уравнения окислительно-восстановительных реакций с электронными балансами:
а) Cu + HNO3 (разб) ![]()
б) Cr + HNO3 (разб) ![]()
в) Ag + HNO3 (конц) ![]()
г) S + HNO3 ![]() H2SO4
+ NO
H2SO4
+ NO
д) P + HNO3 ![]() H3PO4
+ NO2 + H2O
H3PO4
+ NO2 + H2O