Формирование понятия "степень окисления" очень важно в курсе химии 8 класса. Предлагаемый урок имеет целью сформировать понятие степени окисления, опираясь на знания учащихся, полученные ими на предыдущих уроках: атомы, молекулы, химический элемент и простое вещество, сложное вещество, виды химической связи. Поэтому намеренно актуализации знаний уделено достаточно большое место в этом уроке. В своей работе я всегда придерживаюсь мнения, что необходимо добиться от учащихся понимания какого-либо явления и процесса, тогда ребенок сможет легко перенести знания в новую ситуацию, а не машинально выполнять задания по образцу (хотя и эта способность не у всех есть). Хотелось бы отметить, что данный урок не является "открытым", в том смысле, в котором мы обычно применяем это слово - это обыкновенный рабочий урок.
Предлагаемый урок можно использовать как при работе по программе О.С.Габриеляна, так и по программе Н.С.Новошинской и И.И.Новошинского.
Единственное отличие: в учебнике О.С.Габриеляна речь не идет о валентности на этом этапе изучения предмета, поэтому при необходимости эту часть объяснения можно убрать, добавив номенклатуру бинарных соединений.
Задания даны по учебнику: Новошинский И.И., Новошинская Н.С.., Химия. 8 кл.: Учебник.- М.: Русское слово, 2010.
Цель: сформировать понятие о степени окисления на основании знаний учащихся о видах химической связи. Научить находить степень окисления по формуле и составлять формулы по степени окисления.
Оборудование: мультимедийный проектор, ноутбук
Тип урока - комбинированный
Ход урока
1. Оргмомент
Приветствие, сообщение темы и целей урока
Тема урока: "Степень окисления" Слайд 1 Презентация
Цель нашего занятия разобраться, что такое степень окисления и научиться её находить Слайд 2
2. Актуализация знаний.
Давайте начнем урок с рассмотрения очень знакомого вам вещества поваренной соли.
Слайд 3
Как влияет поваренная соль на наш организм?
Влияние соли на организм человек заметил очень давно. Недаром в пословицах её ставят наравне с хлебом: "Хлеб да соль" самое главное пожелание добра у русского человека. А ещё говорят "Чтобы узнать человека надо с ним съесть пуд соли". А за какое время это возможно? Кто-то знает?
В год человек потребляет 3,5 -5,5 кг соли.
А, интересно, как повлияют натрий и хлор на наш организм?
Слайд 4
Натрий хранят как Кощееву смерть под семью замками. Вспомните, как это описано в сказке.
Натрий под слоем керосина в стеклянной банке, стеклянная банка в жестяной, на дне которой асбестовая крошка, банка в сейфе, сейф в лаборантской и т.д.
Все потому, что натрий может реагировать с водой и с составными частями воздуха.
Посмотрим опыт
Как повлияет на человека простое вещество натрий?
Слайд 5
А вот как описывает английский поэт Уилфред Оуэн действие простого вещества хлора на человека:
Газ! Газ! Скорей! - неловкие движенья,
Напяливание масок в едкой мгле!
Один закашлялся, давясь и спотыкаясь,
Барахтаясь, как в огненной смоле,
В просветах мутного зелёного тумана.
Бессильный, как во сне, вмешаться и помочь,
Я видел только - вот он зашатался,
Рванулся и поник - бороться уж невмочь.
Хлор использовался как отравляющее вещество во время Первой мировой войны.
Так почему же поваренная соль имеет другие свойства?
Сейчас мы в этом разберемся.
3. Объяснение нового материала
Открывайте тетради, записывайте число и тему урока "Степень окисления"
Не забудьте отступить 4 клетки.
Слайд 6
Чтобы разобраться в нашем вопросе, давайте запишем строение атомов Na и Cl
Na0 +11 2е,8е,1е
Cl0 +17 2e,8e,7e
Натрий - Ме, хлор - неМе, какая связь может образоваться между ними?
Допишите на схемах как образуются ионы.
Запишите схему образования связи
Na0 + Cl0 > Na+ + Cl- -> Na+Cl-
Все дело в том, что поваренная соль состоит из ионов, а ионы имеют свойства, отличные от свойств атомов.
Какой вид связи в хлориде натрия?
В соединении один ион натрия нейтрализуется одним ионом хлора - вещество не имеет заряда, т.е. 0
Поваренная соль - бинарное соединение, т.к. состоит из двух элементов.
На первом месте всегда пишут "обделённый" элемент, у которого отобрали электроны, т.е. "+", на втором " - "
Слайд 7
Давайте вспомним, как образуется молекула хлороводорода
За счет чего дополняется внешний уровень у ковалентных соединений?
Какие заряды приобрели бы атомы водорода и хлора, если бы электрон совсем перешел от водорода к хлору?
Слайд 8
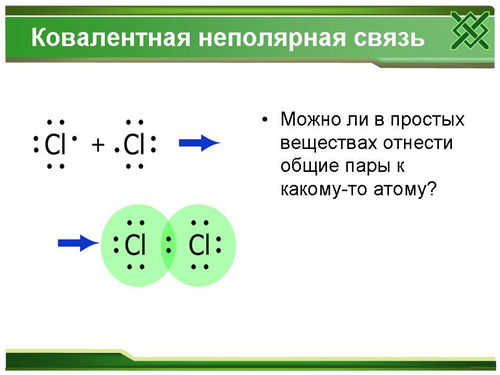
А теперь вспомним образование молекулы хлора.
Какой в ней вид связи?
За счет чего образуется?
Образуются ли заряды у атомов хлора? Почему?
Слайд 9
Сравним соединения NaCl, HCl, Cl2
Определим валентность Na, Cl, H. Правильно, она равна I
Валентность показывает число связей и не зависит от полярности молекулы.
Слайд 10
Степень окисления - это условный заряд атомов химических элементов в соединении, вычисленный на основе предположения, что все соединения состоят из ионов
4. Физкультминутка
5. Объяснение нового материала
Слайд 11
Рассмотрим правила определения С.О.
- С.о. атомов в простых веществах = 0
- С.о. фтора = -1
- С.о. кислорода = -2 (кроме Н2О2-1, O+2F2)
- С.о. водорода = +1 (кроме МеН-1)
- С.о.Ме I, II, III групп = номеру группы
- С.о неМе "+" = номеру группы
- С.о. неМе "-" = 8 - номер группы
Слайд 12
Некоторые элементы имеют постоянную степень окисления, а некоторые переменную
У элементов с переменной с.о. различают максимальную, минимальную и промежуточную с.о.
- Положительная "+" равна числу отданных электронов. Максимальная с.о. равна номеру группы
- Отрицательная "-" равна числу принятых электронов. Минимальная с.о. равна 8 - номер группы
- Нулевое значение с.о. имеют атомы в молекулах с неполярной связью
Слайд 13
Попробуем определить с.о. серы
- Максимальная +6 SO3
- Минимальная -2 H2S
- Сера может проявлять с.о. 0,+2,+4 - это промежуточные с.о.
Слайд 14
Теперь применим те правила, с которыми познакомились сегодня для определения с.о. в соединении
N2O3
На первом месте стоит элемент с "+" с.о., на втором с "-"
У кислорода постоянная с.о.=-2
У азота переменная с.о.
x -2
N2O3
Стр.67 прочитайте как найти x
Объясните, как найти х двумя способами.
6. Закрепление изученного
Слайд 15
Задание 1
Определите С.О. по формулам
Cl2O7, NaH, Na2S, MgO, H3N, N2, Al2S3, Cu2O
7. Подведение итогов
Всем, кто был у доски поставить оценки
8. Д/з
Слайд 16
Параграф 20 упр. 2,4 стр.68