Цель: сформировать компетентность учащихся по теме на основе межпредметных связей (физика и химия) в умении применять знания.
Задачи:
- Образовательные – изучить строение, состав атомных ядер, изотопы
- Развивающие – развивать научное мышление при установлении причинно-следственных связей, сравнении химических объектов, применении знаний и умений в новых ситуациях, в том числе, для решения межпредметных проблем; развивать интерес и другие мотивы изучения химии при знакомстве с историей становления идеи о делимости атома в науке и научными работами ученых.
- Воспитательная – формировать умение работать с книгой через групповую работу, воспитание чувства сотрудничества, сотворчества, создание условий для реальной самооценки учащихся.
Тип урока: урок изучения нового материала и первичного закрепления новых знаний.
Технология: деятельностный подход
Методы и приемы обучения: частично-поисковый, проблемно-дискуссионный, использование информационно-коммуникативных технологий, межпредметная беседа, диалогическое изложение, групповая работа при коррекции и первичном контроле.
Оборудование: периодическая система химических элементов Д.И.Менделеева, таблицы по теме “Состав и строение атома”, опорные конспекты, заполняемые по ходу урока, электронная презентация к уроку.
Планируемые результаты:
- Усвоение учебного материала:
Знать: понятие “атом”, “химический элемент”.
Уметь: объяснять физический смысл атомного (порядкового) номера химического элемента, уметь описывать химический элемент с точки зрения строения атома. - Усвоение на межпредметном уровне понятие “изотоп” и развитие понятия “химический элемент”.
Ход урока
1. Мотивационно-ориетировочный этап.
Учитель:
- Вспомните, что изучает химия?
- Из чего состоят вещества?
- Что такое химический элемент?
Итак, мы знаем, что мельчайшей частицей вещества является атом: одинаковые атомы, или атомы одного вида, называются химическим элементом (запись в разделе “Что мы знаем?” Приложение № 1)
Слово “атом” придумал очень давно, более 2500 лет назад, древнегреческий философ Демокрит. С греческого “атом” переводится как “неделимый”. Так ли это?
Прочтите, пожалуйста, поэтические строчки:
(Информация № 1 в Приложении № 2, Слайды 1, 4, 5.)
Элементы встали вряд,
В ядрах их растет заряд.
Значит столько в нем протонов,
А в округе – электронов.Есть в ядре еще нейтроны,
Что заряд иметь не склонны.
Ну а то, что в массе дробь,
В том виновен изотоп.
- Что вы узнали из данной информации?
- Смысл каких слов вам не понятен?
- Как вы думаете, о чем пойдет речь на сегодняшнем уроке?
- Найдите в информации в состав чего входят протоны, электроны, нейтроны?
- Сформулируйте тему урока (запись темы на доске).
- Каковы цели сегодняшнего урока? (Запись на доске в разделе “Что хотим узнать?” Приложение № 1, Слайды 1,2,3.)
2. Актуализация знаний по вопросу: История изучения состава атома.
Учитель: В истории развития физики одна из самых интересных и увлекательных страниц – это история открытия сложного строения атома. В конце ХI – начала ХII в. идеи о строении атома витали в воздухе, различные догадки ученых создавали духовную атмосферу, в которой, в конце концов, и рождалось открытие, ведь в это время ничего о внутреннем строении атома не было известно.
Какими же великими открытиями была доказана сложность строения атома?
Для этого вам предстоит прочесть материал учебника (с. 38–40) и осуществить описание по плану:
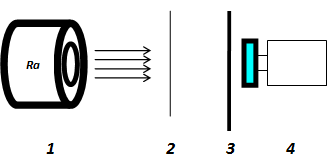
А) Открытие физика Д.Стони_________________________________
_____________________________________________________________
Б) Открытие физиков Д.Томсона и Ж.Перрена
(Дорисуй модель, укажи размеры.)
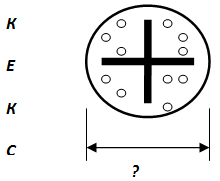
В) Открытие физика А.Беккереля_________________________________________________
Г) Схема опыта Э. Резерфорда.
Заполни:
1. –_______________ ;
2. –_______________ ;
3. –_______________ ;
4. –_______________ .
(Дорисуй возможные дальнейшие направления движения ά– частиц.)
Д) Планетарная модель атома
1-________________________________
2-________________________________
(Укажи размеры атома.)
(Последующее обсуждение вопросов. Просмотр Слайдов 6, 7. Самооценка и выставление баллов в карту оценки участия в уроке по 3 бальной шкале.)
Учитель: Какой вывод можно сделать из полученной информации? (В начале 20 в. разрушились представления о неделимости атома. Атом – сложная частица.)
3. Операционно-исполнительский этап (работа в группах).
Учитель: Используя информацию № 2 в Приложении № 2 и наглядный материал “ Как устроен атом” (из серии электронных учебных пособий), докажите сложность строения атома, для этого вставьте пропущенные слова в тексте:
- Модель атома, предложенная Резерфордом, называется …
- Атом – это частица, состоящая из …
- В состав ядра атома входят … и …
- Протон – элементарная частица, имеющая массу приблизительно … и заряд равный … Для протона принято обозначение…
- Ядро атома имеет… заряд
- Нейтрон – элементарная частица, имеющая массу приблизительно … и заряд равный … Для нейтрона принято обозначение…
- Вокруг ядра постоянно движутся …, их заряд – …, а масса – …
- Масса атома сосредоточена в …, т.к. массой … можно пренебречь.
- Атом электронейтрален, т.к. …
- По разности … определяют число нейтронов в атоме.
Учитель: Что у вас получилось? (Устные ответы учащихся. Запись на доске в разделе Что узнали? Выставление оценок в карту оценки участия в уроке по 3 бальной шкале. Просмотр Слайдов 8–10.)
Учитель: По полученному тексту попытайтесь составить схему строения атома (работа в группах).
(Учитель проходит по рядам и выясняет: какая из схем более полно и точно отражает строение атома. Более точная схема выносится на доску или показывается соответствующий слайд презентации.)
Учитель:
1. Как вы понимаете задание: определить состав атома?
2. Попытайтесь составить алгоритм, т.е. порядок действий, который позволит
определить состав атома. Я дам вам подсказки, а вы расставьте их в нужном
порядке (Что значит, определить состав атомных ядер? Как можно определить число
протонов, нейтронов? Как найти количество электронов в атоме?)
Учитель: Какие последовательности у вас получились? (на слайде№11 выводится алгоритм, демонстрируется пример):
- N = – см. ПСХЭ
- N = Z = число р+
- Число n0 = Ar – Z
- Число е = числу р+
Учитель: Используя данный алгоритм, выполните задание: заполните таблицу. (Каждый участник команды выполняет одно задание и карточку передает другому ученику.)
| Знак химического элемента | Название | Число протонов | Число нейтронов | Число электронов |
| S | ||||
| Алюминий | ||||
| 14 | ||||
| 20 | ||||
| К |
Подводится итог: за правильно выполненное задание выставляются баллы (взаимопроверка. Слайд 12).
Критерии оценки: без ошибок – молодец (3б.),1–2 ошибки – не все потеряно (1–2б.), 3–4 ошибки – стоит обратить на это особое внимание (0б.).
4. Формирование практических навыков.
Учитель: Нам известно, что свободные атомы – это одна из форм существования химического элемента.
Другого ничего в природе нет,
Ни здесь, ни там, в космических глубинах:
Все от песчинок малых до планет –
Из элементов состоит единых.
В настоящее время известно 114 химических элементов, получены первые атомы элемента с номером 116. Давайте обратимся к периодической системе химических элементов Д.И.Менделеева и посмотрим, какими числами представлены в ней относительные атомные массы элементов? Если масса атома определяется количеством протонов и нейтронов, массы которых выражены целыми числами, то почему относительные атомные массы представляют собой дробные величины? (Постановка учебной проблемы.) На эти вопросы мы будем искать ответы в ходе мысленного эксперимента с опорой на модели.
1) Изменение числа нейтронов в атоме водорода.
Решение задачи: Что произойдет с атомами одного и того же вида, если
в их ядра мысленно добавить по 1 нейтрону?
Для примера возьмем атом с самым простым строением – атом водорода.
- Найдите среди моделей ядро этого атома. Сколько протонов он содержит? (Один.) Эта разновидность атома носит название протий (из-за простоты строения).
- Мысленно добавьте в этот атом 1 нейтрон. Изменилась ли масса атома? (Да, она равна массе протона и нейтрона, массу электрона из-за ее очень малой величины не учитываем.)
- Сравните модели ядра протия и полученного атома. Такой атом водорода называют дейтерием.
- Мысленно добавьте теперь уже в ядро дейтерия один нейтрон. (Далее
рассуждения аналогичны выше изложенным.) Полученный атом называют
тритием.
Итак, мы имеем три модели, три разновидности атомов водорода с различными массами.
Как же называют разновидности атомов одного и того же вида (в нашем случае – атомов водорода), имеющие один и тот же заряд ядра атома, но разные массы? Посмотрите в периодической системе химических элементов. В ней всем разновидностям атома водорода отведено одно и то же место. Поэтому, они получили название изотопы (“изос” – равный, одинаковый, “топос” – место), т. е. занимающие одно и то же место.
2) Оформление результатов мысленного эксперимента в тетрадях и на доске (Совместное заполнение таблицы и формулировка понятия “изотопы”.)
Оформим результаты наших рассуждений в тетрадях.
| Частицы | Протий 1H | Дейтерий 2D | Тритий 3T |
| Z=1 | |||
| Протон | 1 | 1 | 1 |
| Электрон | 1 | 1 | 1 |
| Нейтрон | 0 | 1 | 2 |
Изотопы – это … (Продолжение записи на доске в разделе “Что узнали?”)
Учитель: Давайте послушаем учащегося, который расскажет, какую интересную информацию он нашел об этих изотопах.
Учащийся (рассказывает и презентует материал “Знаете ли вы”, который подготовил самостоятельно дома). Приблизительный вариант:
- Протий – обычный водород, дейтерий – тяжелый водород, тритий – сверхтяжелый водород
- Тяжелый водород содержится в обычном водороде в небольших количествах: на 5 тыс. атомов обычного водорода приходится 1 атом тяжелого.
- Вода, в которой протий заменен дейтерием, называется тяжелой. Тяжелая вода характеризуется особыми свойствами: температура замерзания +3,8 С0, температура кипения +101,4 С0, плотность 1,1г/мл.
- В тяжелой воде невозможна жизнь.
- Сверхтяжелый водород в природе встречается крайне редко. Доля его ничтожно мала: один атом трития приходится на миллиард миллиардов атомов обычного водорода.
- Тритий является радиоактивным изотопом водорода.
- Совсем недавно появилось сообщение о новом изотопе водорода с атомной массой равной 4. Насколько трудной была задача обнаружения нового “сверхтяжелого” водорода, говорит время его существования, равное 0, 000 000 000 01 доли секунды.
Учитель: Так почему же относительные атомные массы химических элементов, указанные в периодической системе Д.И.Менделеева, не целые, а дробные величины?
Учащийся: Это средняя арифметическая величина, в которой учтены не только массы всех изотопов, но еще и процентное содержание в природе. Поэтому получаемые при расчетах величины оказываются не целыми, а дробными.
Учитель: В ядре атома химического элемента А содержится 11 протонов и 12 нейтронов, а в ядре атома химического элемента В -12 протонов и 12 нейтронов.
Определите, являются ли они:
– изотопами одного элемента;
– атомами двух химических элементов, у которых одинаковое массовое число;
– атомами двух разных элементов, находящихся в периодической системе рядом.
(Слайд 13)
Учитель:
Собрать, сколько надо, частиц всех сортов,
И атом – пожалуйста, – вот он, готов!
Но в общее дело их вклады неравны…
Так кто же из этих частиц самый главный?
Пузатый протон, флегматичный нейтрон,
А может быть, юркий малец – электрон?
Итак, предположите, какая же частица в атоме главная? (Постановка учебной проблемы.)
Решение учебной проблемы основывается на известной учащимся информации:
- Нейтрон?
Учащийся: Главной характеристикой любого химического эксперимента является содержание в нем протонов, а точнее, значение положительного заряда ядра атома, определяемое числом протонов.
Учитель: Исходя из этого, дайте современное, новое определение понятия “химический элемент”.
Учащийся: Химический элемент – это совокупность атомов с одинаковым зарядом ядра.
Учитель: Итак, подведем итог. Вспомни начала урока: Что мы знали? Что хотели узнать? А что же узнали?(анализ записей на доске, получившихся к концу урока. Приложение № 1. Слайд 14)
5. Диагностика и коррекция первичного усвоения материала
Учитель: Предлагаю вашему вниманию сочинение бывшей выпускницы нашей школы. Как вы думаете, о чем идет речь в сочинении:
“Атом мне представляется одной большой семьей. В центре семьи, конечно же, родители: очень добрая, заботливая, положительная мама и строгий, но справедливый, словом нейтральный папа. А вокруг них вечные двигатели, вечные прыгатели – дети, которые не присядут ни на минутку. Они словно маленькие “энерджайзеры”, у них много-много дел, им хочется все увидеть, все услышать, все узнать. И чем больше запас их энергии, тем дальше убегают они от родителей. Для того чтобы семья была гармоничной: чтобы дети могли получить хорошее образование, развивать свои способности в музыкальной школе, в изостудии, в танцевальных коллективах, в спортивных секциях и т.д.; чтобы папа и мама могли позволить себе посещать театры, концерты, путешествовать и прочие радости жизни, родители очень много трудятся. Папа выполняет нейтральные дела, а мама – только положительные, за каждое дело они получают единицу зарплаты. Поэтому общая зарплата папы и мамы составляет доход всей семьи. Чем больше в семье детей, тем больше трудятся родители. Вот такой он крошечный, невидимый, но сложный и интересный атом”.
Как вам кажется, ребята, какими научными терминами можно назвать: положительная мама, нейтральный папа, дети, нейтральные дела, положительные дела, единица зарплаты, доход всей семьи?
Далее с учащимися проводится игра “Верю – не верю”. (Слайд 15)
Верите ли вы, что:
- Только электроны входят в состав атома?
- Электроны, положительно заряженные частицы?
- Количество нейтронов и электронов одинаковое?
- Атомная масса равна количеству нейтронов?
- У всех элементов одинаковое строение атома?
- Число протонов в атоме водорода равно 2?
- Число электронов в атоме углерода равно 6?
Учитель подводит итоги урока, проверяет диагностичность цели урока, оценивает работу групп и отдельных учащихся. Подводятся итоги в картах по оценке участия обучающихся на уроке.
Учитель: В завершении урока прошу закончить следующие предложения:
8. Сегодня я узнал_______________________
9. Я удивился___________________________
10. Теперь я умею_______________________
11. Я хотел бы __________________________
6. Домашнее задание. (Слайд 16)
- Прочесть параграфы 6, 7; выполнить упражнения 3,5 с.43 и (обязательный уровень).
- Творческие задания:
- Используя изученные на уроке термины, составить кроссворд по теме “Строение атома”.
- Сочинить историю в любом жанре (сказка, басня, детектив и т.д.): на что, по-вашему, похож атом.