Цели урока:
- Образовательная:закрепить понятие непредельные углеводороды; изучить свойства и применение ацетилена;
- Развивающая:научить пользоваться приемами сравнения, обобщения, делать выводы, расширять познавательные интересы.
- Воспитывающая: воспитывать интерес к предмету химия.
Оборудование: мультимедийный проектор, компьютер. Урок сопровождается презентацией, электронное пособие «Виртуальная лаборатория. Химия 8-11 класс», интернет ресурсы.
Тип урока: комбинированный.
Форма занятия: урок изучения нового материала с использованием ИКТ.
ХОД УРОКА
I. Организационный момент
II. Изложение нового материала
Загадка
– Горит с образованием углекислого газа и воды, но не алкан;
– Обесцвечивает бромную воду, но не алкан;
– Подчиняется общей формуле СnH2n–2 , но не алкадиен.
Подсказка – содержит 2 атома углерода.(Слайд 2)
1. Алкины – это алифатические (ациклические), непредельные (ненасыщенные) углеводороды, с одной тройной углерод-углеродной связью
С ≡ С в цепи и общей формулой СnH2n–2
2. Строение
Ацетилен – первый член гомологического ряда ацетиленовых углеводородов, или алкинов.
Молекулярная формула ацетилена C2H2
Структурная формула ацетилена H–C≡C–H
Электронная формула H : С : : : С : Н
Углеродные атомы ацетилена, связанные тройной связью, находятся в состоянии sp-гибридизации. При образовании молекулы ацетилена у каждого атома С гибридизуются по одной s- и p-орбитали. В результате этого каждый атом С приобретает по две гибридных орбитали, а две p-орбитали остаются негибридными. Две гибридных орбитали взаимно перекрываются, и между атомами С образуется σ-связь. Остальные две гибридных орбитали перекрываются с s-орбиталями атомов H, и между ними и атомами С тоже образуются σ-связи. Четыре негибридных p-орбитали размещены взаимно перпендикулярно и перпендикулярно направлениям σ-связей. В этих плоскостях p-орбитали взаимно перекрываются, и образуются две π-связи, которые относительно непрочные и в химических реакциях легко разрываются.
Таким образом, в молекуле ацетилена имеются три σ-связи (одна связь C–C и две связи C–H) и две π-связи между двумя С атомами. Тройная связь в алкинах – не утроенная простая, а комбинированная, состоящая из трех связей: одной σ- и двух π-связей.
Молекула ацетилена имеет линейное строение. Появление третьей связи вызывает дальнейшее сближение атомов С: расстояние между их центрами составляет 0,120 нм.

sp-гибридные орбитали двух атомов углерода в состоянии,
предшествующем образованию тройной связи и связей C–H
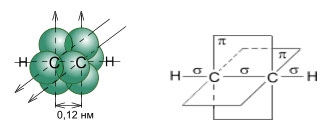
Схематическое изображение строения молекулы ацетилена (ядра атомов углерода и водорода на одной прямой, две p-связи между атомами углерода находятся в двух взаимно перпендикулярных плоскостях) (Слайды 4,5)
3. Физические свойства
С2Н2 – Ацетилен – бесцветный газ, легче воздуха, мало растворим в воде, в чистом виде почти без запаха.
Свойства гомологов изменяются аналогично алкенам. По физическим свойствам алкины напоминают алкены и алканы. Температуры их плавления и кипения увеличиваются с ростом молекулярной массы. В обычных условиях алкины С2–С3 – газы, С4–С16 – жидкости, высшие алкины – твердые вещества. Наличие тройной связи в цепи приводит к повышению температуры кипения, плотности и растворимости их в воде по сравнению с олефинами и парафинами. (Слайд 6)
4. Химические свойства алкинов
1. Реакции присоединения
1) Галогенирование – стадийно, до производных алканов:
(как и алкены обесцвечивают бромную воду!)
СH≡CH + Br2 → CHBr=CHBr (1,2-дибромэтен)
CHBr=CHBr + Br2 → CHBr2–CHBr2 (1,1,2,2-тетрабромэтан)
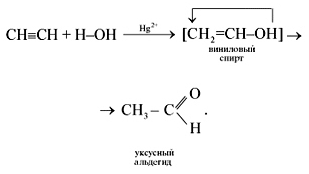
2) Гидратация – (реакция М.Г. Кучерова)
CH≡CH + H2O Hg2+,H+→ [CH2=CH–OH] → CH3–CH=O
протекает в присутствии солей ртути(II) – HgSO4, Hg(NO3)2 – с образованием уксусного альдегида:
Эта реакция носит имя русского ученого Михаила Григорьевича Кучерова (1881).
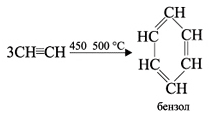
3) Полимеризация
В определенных условиях ацетилен способен полимеризоваться в бензол и винилацетилен.
При пропускании ацетилена над активированным углем при 450–500 °С происходит тримеризация ацетилена с образованием бензола (Н.Д.Зелинский, 1927 г.):
2. Реакции окисления и восстановления
1) Горение – пламя сильно коптящее
СnH2n–2 + (3n–1)/2O2 t → nCO2 + (n–1)H2O + Q
R–C≡C–H + [Cu(NH3)2]Cl → R–C≡C–Cu↓ + NH4Cl +NH3
Ацетилениды серебра и меди (I) – разлагаются соляной кислотой:
R–C≡C–Cu↓ + HCl → R–C≡C–H + CuCl
Ацетилениды металлов – взрывчатые вещества!
3. Применение ацетилена (Слайд 7)
III. Закрепление материала: (Слайд 9)
– К каким углеводородам относятся алкины?
– Какая особенность в строении алкинов?
– Как получить газ ацетилен?
– Где применяют ацетилен?
IV. Подведение итогов. Выставление оценок.
V. Домашнее задание. Учебник О.С.Габриелян «Химия 10 класс», конспект.