Цели урока:
- Проверка, корректировка и углубление знаний учащихся по теме “Электролиз” через эксперимент и решение задач.
- Формирование навыков техники выполнения эксперимента, умения решать расчетные и качественные задачи, составлять химические реакции, протекающие при электролизе растворов и расплавов электролитов.
- Воспитание самостоятельности, организованности, развитие творческих способностей, логического мышления, внимания, памяти.
Оборудование: источник питания на 5 В, раствор сульфата меди (II), приборы для проведения электролиза (6 шт), лабораторные амперметры (3 шт), электронные весы, ключи, реостаты, соединительные провода, часы, лабораторные стаканы, зажимы, ноутбуки (6 шт), интерактивная доска, карточки с лабораторными, текстами задач.
Ход урока
I. Организационный этап. (1 минута)
Учитель химии: Здравствуйте, на прошлом уроке мы рассмотрели теоретически процессы, проходящие при электролизе. Ребята, сегодня мы закрепим и обобщим знания и практические умения по данной теме, не совсем обычно. Мы проведем интегрированный урок химии с физикой.
Учитель физики: Физика и химия – необыкновенные науки. Их законы универсальны. Они с успехом объясняют свойства кристаллов и живых клеток, помогают производить стыковку космических кораблей и выполнять сложнейшие операции. Сегодня мы рассмотрим связь между физикой и химией на примере одного процесса.
Учитель химии: Работу на уроке будем проводить по группам. 1 ряд - группа “Физики-экспериментаторы”, 2 ряд - группа “Теоретики”, 3 ряд - “Химики-экспериментаторы”.Будьте внимательны, активны, организованны. Оценку за практическое занятие вы получите итоговую, основными показателями качества вашей работы будут четкость и глубина ответов, аккуратность выполнения эксперимента, правильное решение задач, выполнение домашнего задания.
II. Актуализация опорных знаний. Фронтальный опрос. (13 минут)
Учитель физики: Начнём с эксперимента, который проведёт ( ).
Демонстрация: Собирается схема (источник тока, лампа, угольные стержни, соединительные провода, 2 стакана один с водой , другой с солью, стеклянная палочка)

Соединим с источником тока последовательно лампочку и стакан с дистиллированной водой, в который опущено два угольных электрода. Замкнув цепь, мы видим, что лампа не горит, значит ток в цепи отсутствует. Теперь возьмем стакан с поваренной солью, добавим воды, слегка перемешав, замкнём цепь. Обнаруживаем, что лампа, включенная в цепь, светиться.
Вопросы: Выводы по наблюдениям делают учащиеся:
- сухая соль не проводит ток, так как нет свободных зарядов;
- дистиллированная вода – тоже, а растворы солей, кислот и щелочей – проводят, так как есть свободные заряды.
Опрос проводит ученик.
1. Что называется электрическим током? (направленное движение заряженных частиц)
2. На какие группы делятся все вещества по способности проводить электрический ток? (проводники, полупроводники, диэлектрики)
3. В каких средах может идти ток? (в проводниках, полупроводниках Проводники:
1. твердые – все металлы;
2. жидкие – растворы солей, кислот, щелочей;
3. газообразные – газы при особых условиях.)
4. Что является носителями зарядов в этих проводниках? (положительные и отрицательные ионы и электроны)
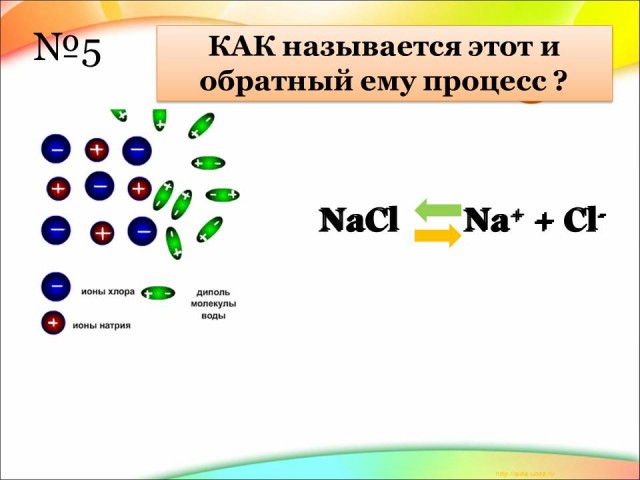
5. Как называется этот процесс? (Электролитическая диссоциация – это распад веществ на ионы в растворах и расплавах. Обратный процесс называется рекомбинацией).
Вывод ученика: При растворении электролитов под влиянием электрического поля полярных молекул воды происходит распад молекул электролитов на ионы.
Учитель химии:
1. Ребята, что мы будем наблюдать, если через раствор или расплав пропустить постоянный электрический ток? (электролиз)
2. Дайте определение электролиза? (Электролиз – это процесс выделения на электродах веществ, связанный с окислительно – восстановительными реакциями.)
3. Назовите два вида электролиза? (в растворах и в расплавах)
4. Процессы окисления и восстановления на электродах протекают в определённой последовательности. Давайте вспомним, каким образом восстанавливаются металлы из растворов? (существует 3 группы металлов в ряду напряжений металлов.....)
Выполним задание на интерактивной доске
5. Возьми (___________) карандаш, и выбери из папки с металлами те, которые полностью восстанавливаются................)
6. Вспомним окисление аниовов.............
Учитель физики: Мы выяснили, какие металлы полностью восстанавливаются при электролизе. В прошлом году, при изучении темы “Электрический ток в различных средах”, мы решали задачи на применение физического закона, с помощью которого можно определять массу веществ, выделявшихся на электродах Что это за закон? (закон Фарадея)
Сформулируйте закон Фарадея?
(1 закон Фарадея был открыт экспериментально в 1833 году.
m= k лQ - масса вещества, выделившаяся при электролизе на каждом из электродов, пропорциональна количеству электричества, прошедшего через электролит.
k - электрохимический эквивалент (кг \ Кл)
Q – количество электричества (Кл)
2 закон Фарадея
![]() Электрохимический эквивалент прямо
пропорционален химическому.
Электрохимический эквивалент прямо
пропорционален химическому.
M - Молярная масса (Г \ моль)
n - Валентность
F - Число Фарадея F= 95500 Кл \ моль
III. Практическая часть. (15 минут).
Учитель физики: Хорошо, а теперь приступим к практической части. Работа в группах. Физики-практики и химики- практики приступают к выполнению лабораторных работ (по плану который найдут у себя на столе) и предварительно ознакомившись с инструкцией по технике безопасности, а теоретики, внимание на экран.
Фильм-задачка (видео):
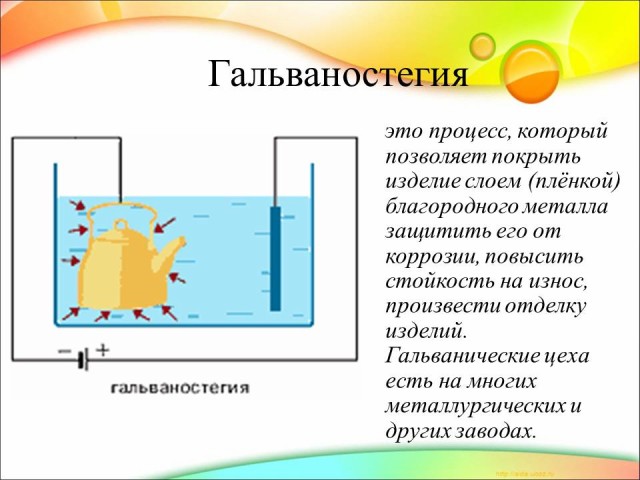
Для защиты металлических изделий от коррозии на их поверхность наносят тончайший слой другого металла: хрома, серебра, золота, никеля и т.д. При нанесении покрытий на металл электролизом изделия получаются ровными по толщине и прочными. Внимание вопрос. Рассчитайте массу серебра которая образуется при электролизе водного раствора нитрата серебра с графитовыми электродами на аноде, если выделился кислород массой 6 г.
Учитель физики: Как будем решать поставленную перед нами задачу? (составим химические схемы процесса и из уравнения найдём массу серебра, другой ученик - используем закон Фарадея). Оба варианта верны: (............) выдут к доске и напишите каждый своё решение, остальные работают самостоятельно
| Решение 1. (химическое) Составим схемы электродных процессов электролиза: 4 на катоде:1 на аноде:
Суммарный процесс: 4Ag+ + 2H2O Из суммарного уравнения видно, что при образовании 1 моль кислорода выделяется 4 моль серебра, т.е. m(Ag0) =4n(O2) = 4*6/32 = 0,75(моль). m(Ag0) = 0,75* 108 = 81(г) |
Решение 2. (физическое) Из объединенной формулы законов Фарадея масса выделившегося вещества равна: m = Q*M / z *F где Q - количество электричества, пропущенного через электролизер; М - молярная масса выделившегося вещества; F - постоянная Фарадея, равная 96 500 Кл/моль; z - число электронов, участвующих в электродном процессе. Преобразовав формулу, получаем: Q = m*z*F/M; Q = 6*4*96 500/32 = 723,75 (Kл). Такое же количество электричества было затрачено на выделение серебра. Следовательно, масса выделившегося серебра равна: m = 72 375 *108/1*96 500 = 81 (г). |
Задача 2. На заводе был подвергнут электролизу раствор, содержащий 468 кг хлорида натрия. Полученные газы были использованы для синтеза хлороводорода. Образовавшийся хлороводород растворили в 708 л воды. Рассчитайте массовую долю хлороводорода в полученной соляной кислоте.
Задача 3. Для серебрения ложек ток 1,8А пропускался через раствор соли серебра в течении 5 ч. Катодом служит 12 ложек, каждая из которых имеет площадь поверхности 50 см2. Какой толщины слой серебра отложился на ложках?
IV. Физкультминутка.
(Зрительная гимнастика по Базарову)
V. Анализ практической части. (5 минут)
Учитель физики: Итак, при электролизе на катодах происходит выделение вещества. От чего зависит масса этого вещества, вы устанавливали выполняя лабораторные работы. Что же у вас получилась?
Поочередно спрашивает результат, полученный каждой группой при выполнении эксперимента. Затем включаем микрокамеру (наблюдаем слой меди на угольном стержне) и учащиеся делают и записывают общий вывод в тетрадь: масса вещества выделяемого на электродах зависит от напряжения, концентрации раствора, расстояния между электродами, площади электродов.
Учитель химии: Химики-экспериментаторы проводили окислительно-восстановительные реакции. Ваши результаты. Спасибо.
Учитель химии: Любое научное открытие или вывод интересен только тогда, когда находи практическое применение. О том, где нашел свое применение Электролиз, вы выясняли самостоятельно, в качестве домашнего задания. Проверим его.
Учитель физики: Вы экспериментально подтвердили, что с помощью электролиза можно получать разные вещества, в частности, медь. В промышленности электролизом получают и другие металлы, например алюминий. Давайте посмотрим, фрагмент фильма, который смонтировал ваш одноклассник.
VI. Получение алюминия.(фильм) (2 минут)
VII. Итоги урока. (сначала это делают учащиеся, а затем учитель)
Учитель химии: Итак, ребята, давайте вспомним, чем сегодня мы занимались на уроке?
1. расширили свой научно-технический кругозор, изучая тему “Электролиз”;
2. увидели тесную связь физики с химией и с производством.
Учитель физики: Сегодня на уроке мы использовали различные подходы к процессу изучения электролиза, как с точки зрения физики, так и с точки зрения химии. В результате нашей творческой работы каждый из нас познал радость открытия, чувства взаимного обогащения друг друга. А обмен информацией в ходе урока привёл к пониманию и познанию.
Выставляются оценки ученикам за активную работу на уроке.
Домашнее задание:
- по физике : учебник 11-го класса “Физика -11” п/р Мякишева В.А., “Дрофа”, М, C. 123;
Рефлексия.
Используемые технологии:
- Проектного обучения.
- Игровая технология.
- Технология интегрированного обучения.
- Групповая технология.
- Технология сотрудничества.
- Технология проблемного обучения